题目内容
3.下图是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题: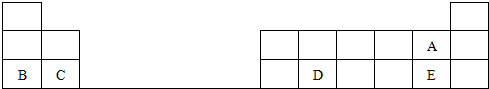
(1)写出D的原子结构示意图
 .
.(2)A、E两种元素所形成的气态氢化物,稳定性HA>HE(填“>”、“<”).
(3)B、C两元素的原子半径,B>C(填“>”、“<”).
(4)在盛有水的小烧杯中加入B的单质,写出该反应的化学方程式2Na+2H2O=2NaOH+H2↑.
分析 由元素在在周期表的位置可知,A、B、C、D、E分别为F、Na、Mg、Si、Cl,
(1)D的原子结构中有3个电子层,最外层电子数为4;
(2)非金属性越强,氢化物越稳定;
(3)同周期,从左向右原子半径减小;
(4)Na与水反应生成NaOH和氢气.
解答 解:由元素在在周期表的位置可知,A、B、C、D、E分别为F、Na、Mg、Si、Cl,
(1)D的原子结构中有3个电子层,最外层电子数为4,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)非金属性A>E,氢化物的稳定性为HA>HE,故答案为:>;
(3)同周期,从左向右原子半径减小,则原子半径为B>C,故答案为:>;
(4)Na与水反应生成NaOH和氢气,反应为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质及元素化合物知识等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.下列关于物质的用途描述错误的是( )
| A. | 氧化铁可用作红色油漆和涂料 | B. | 硅胶可作干燥剂 | ||
| C. | 纯碱可作糕点的发酵粉 | D. | 过氧化钠作呼吸面具供氧剂 |
14.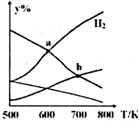 以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )
以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )
 以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )
以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | B. | b点:v正(CO2)=v逆(H2O) | ||
| C. | a点:n(H2)=n(H2O) | D. | 温度不变,充入更多H2,D(CO2)不变 |
18.下列有机反应属于加成反应的是( )
| A. | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H20 |
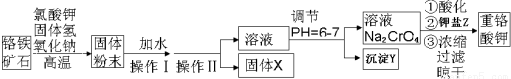
8.硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅.工艺流程如下:

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(I )流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(II) 步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(III )上述流程中可循环利用的物质有FeCl3、HCl.
(IV)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有
Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数α与溶液pH 变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
Ⅰ.由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是加入试剂,Pb2+的浓度转化率为$\frac{(0.1-0.004)}{0.1}$×1005%=96%,Fe3+的浓度转化率为$\frac{0.12-0.04}{0.12}$×100%=67%,所以去除Pb2+比Fe3+效果好.
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为B.
A.4 B.6 C. 10 D. 12.

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(I )流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(II) 步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(III )上述流程中可循环利用的物质有FeCl3、HCl.
(IV)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有
Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数α与溶液pH 变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为B.
A.4 B.6 C. 10 D. 12.
12.碱式碳酸钴[Cox(OH)y(CO3)z常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
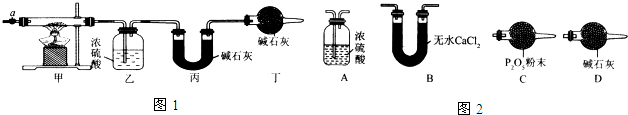
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如表数据.
则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(5)含有Co(AlO2)2 的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
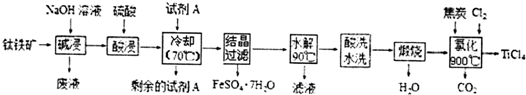
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取 CoCl2•6H2O的一种工艺如图3:
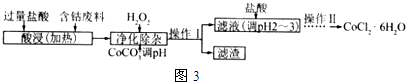
已知:
①净化除杂时,加入 H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3、Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如表数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2 的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取 CoCl2•6H2O的一种工艺如图3:

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3、Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
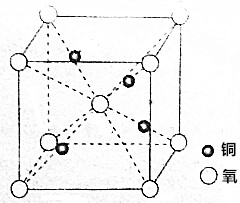 铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.
铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.