题目内容
18.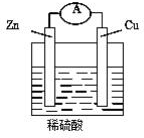 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )| A. | 锌是负极,锌片逐渐溶解 | B. | 铜是正极,铜片上有气泡产生 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 电子从锌片经导线流向铜片 |
分析 该原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应生成氢气;电子从负极沿导线流向正极;溶液中阴离子向负极移动,阳离子向正极移动,据此分析.
解答 解:A、该原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应,锌片逐渐溶解,故A正确;
B、铜作正极,正极上氢离子得电子生成氢气,有气泡产生,故B正确;
C、原电池放电时,电流从正极沿导线流向负极,即电流由铜片流向锌片,故C错误;
D、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故D正确;
故选C.
点评 本题考查学生原电池的工作原理以及应用知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
8.下列离子方程式不正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO | |
| D. | 甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
6.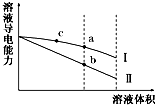 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )| A. | 两溶液稀释前的浓度相同 | |
| B. | a、b、c三点溶液的pH由大到小顺序为a>b>c | |
| C. | a点的KW值比b点的KW值大 | |
| D. | a点水电离的c(H+)大于c点水电离的c(H+) |
13.下列电子式书写正确的是( )
| A. | N2:N:::N: | B. | NH3  | C. | H2O  | D. | KOH  |
3.已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所带电荷数SO42-是Na+的0.6倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
10.下列叙述中正确的是( )
| A. | 氯水、二氧化硫、活性炭的漂白或脱色原理虽然不同,但它们都能使品红或墨迹褪色 | |
| B. | 等物质的量的Cl2和SO2同时与潮湿的红布条作用,红布条立即褪色 | |
| C. | 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸 | |
| D. | 经Cl2和SO2漂白的物质,日后都会恢复原来的颜色 |
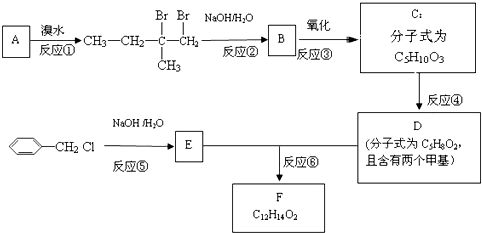
 .
.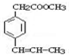 是F的一种同分异构体,属于芳香族化合物
是F的一种同分异构体,属于芳香族化合物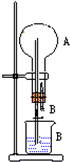 在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.
在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.