题目内容
11.2011年3月日本地震引起福岛核反应堆事故,冷却反应堆需要大量的水,下列有关说法正确的是( )| A. | H20分子中只含有非极性共价键 | |
| B. | H20分子中只含有极性共价键 | |
| C. | 水分子间只存在氢键 | |
| D. | 冷却反应堆用水在地球上常温下是固态 |
分析 水分子中H原子与氧原子之间形成1对共用电子对,由于O元素电负性很大,共用电子对偏向O原子,偏离H原子,共价键为极性键,使的H原子近似裸露的质子,水分子之间形成氢键,冷却反应堆用水在地球上常温下应是液态,通过水循环带走热量使反应堆降温.
解答 解:A.水分子中H原子与氧原子之间形成1对共用电子对,由于O元素电负性很大,共用电子对偏向O原子,偏离H原子,共价键为极性键,故A错误;
B.水分子中共价键为极性键,故B正确;
C.O原子电负性很强,共用电子对偏向O原子,偏离H原子,使的H原子近似裸露的质子,水分子之间形成氢键,水分子之间还存在范德华力,故C错误;
D.冷却反应堆用水在地球上常温下应是液态,通过水循环带走热量使反应堆降温,故D错误,
故选:B.
点评 本题以福岛核反应堆事故为载体,考查共价键、氢键等,注意掌握共价键形成条件与分类,理解掌握氢键的形成,注意氢键对物质性质的影响.

练习册系列答案
相关题目
2.NA为阿伏伽德罗常数,下列物质所含原子数最多的是( )
| A. | 0.8molCH4 | B. | 66gCO2 | ||
| C. | 标准状况下44.8L的O2 | D. | NA个水分子 |
6.现有一种烃的结构式如图所示,命名该化合物时,应认定它的主链上的碳原子数目是( )

| A. | 9 | B. | 10 | C. | 11 | D. | 12 |
2.化学中常用图象直观地描述化学反应的进程或结果.下列对图象的描述正确的是( )
| A. |  根据图可判断可逆反应A2(g)+3B2(g)?2AB3(g),正反应是吸热反应 | |
| B. | 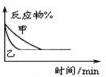 如图表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 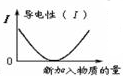 图可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| D. | 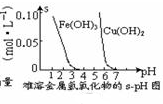 根据图可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
9.2015年12月杭州多日被雾霾笼罩,有报道称雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
Ⅰ.在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.已知:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:4NO2+O2+2H2O═4HNO3.
(2)尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol.
(3)已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.5kJ•mol-1.
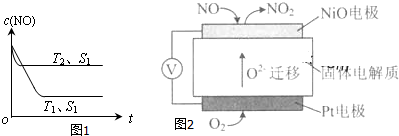
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.若催化剂的表面积S1>S2,在图1中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线.
Ⅱ.还原法.用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
(1)T1℃时,该反应的平衡常数K=0.56(保留两位小数).
(2)30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为 5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
Ⅲ.变废为宝.
(1)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)?CH3OH(g),在一定温度压强下(甲醇为气体),在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,再加入1.0molCO后重新达到平衡,则CO的转化率减小(填“增大”、“不变”或“减小”);
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.
Ⅰ.在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.已知:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:4NO2+O2+2H2O═4HNO3.
(2)尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol.
(3)已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.5kJ•mol-1.
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.若催化剂的表面积S1>S2,在图1中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线.
Ⅱ.还原法.用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(2)30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为 5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
Ⅲ.变废为宝.
(1)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)?CH3OH(g),在一定温度压强下(甲醇为气体),在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,再加入1.0molCO后重新达到平衡,则CO的转化率减小(填“增大”、“不变”或“减小”);
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.

6.某同学用下列装置制备并检验Cl2的性质:
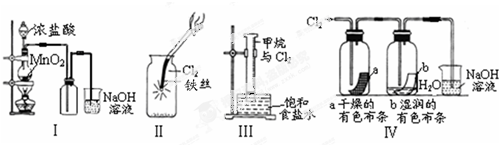
下列说法正确的是( )

下列说法正确的是( )
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
7.下列烷烃在光照下与氯气反应,只生成一种一氯代物的是( )
| A. | CH3CH2CH2CH3 | B. |  | C. |  | D. |  |
 中含有手性碳原子数2个.用“*”对应的碳原子.
中含有手性碳原子数2个.用“*”对应的碳原子.