题目内容
下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ,④元素原子结构示意图为 ,⑦元素的离子结构示意图为 ,⑨元素的离子结构示意图为 .
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 .
(3)④元素与⑦元素形成化合物的电子式 ,①元素与⑦元素形成化合物的电子式 ,④元素与⑥元素形成化合物的电子式 ,⑦元素单质的电子式 ,②元素单质的电子式 .
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式),④,⑤,⑨三种元素的最高价氧化物的水化物中碱性最弱的是 (填化学式).④,⑤,⑥、⑦四种元素中非金属性最强的是 (用元素符号表示).
(5)⑨元素与③元素形成化合物的形成过程 .
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氢氧化物的元素是
(3)④元素与⑦元素形成化合物的电子式
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(5)⑨元素与③元素形成化合物的形成过程
考点:元素周期律和元素周期表的综合应用
专题:
分析:由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)稀有气体化学性质最不活泼;④为Mg,原子核外有3个电子层,各层电子数为2、8、2;⑤为Cl,其离子质子数为17,核外电子数为18,各层电子数为2、8、8;⑨为K,其离子质子数为19,核外电子数为18,各层电子数为2、8、8;
(2)上述元素中Al的氢氧化物--氢氧化铝为两性氧化物,铝与氢氧化钾反应生成偏铝酸钾与氢气;
(3)④元素与⑦元素形成化合物为MgCl2,由镁离子与氯离子构成;①元素与⑦元素形成化合物为CCl4,分子中碳原子与氯原子之间形成1对共用电子对;④元素与⑥元素形成化合物为MgS,由镁离子与硫离子构成;⑦元素单质为Cl2,原子之间形成1对共用电子对;②元素单质为N2,原子之间形成3对共用电子对;
(4)高氯酸是最强的酸;金属性越强,最高价氧化物的水化物的碱性越强;同周期自左而右元素非金属性增强;
(5)⑨元素与③元素形成化合物为KF,由钾离子与氟离子构成,用K、F原子电子式表示其形成过程.
(1)稀有气体化学性质最不活泼;④为Mg,原子核外有3个电子层,各层电子数为2、8、2;⑤为Cl,其离子质子数为17,核外电子数为18,各层电子数为2、8、8;⑨为K,其离子质子数为19,核外电子数为18,各层电子数为2、8、8;
(2)上述元素中Al的氢氧化物--氢氧化铝为两性氧化物,铝与氢氧化钾反应生成偏铝酸钾与氢气;
(3)④元素与⑦元素形成化合物为MgCl2,由镁离子与氯离子构成;①元素与⑦元素形成化合物为CCl4,分子中碳原子与氯原子之间形成1对共用电子对;④元素与⑥元素形成化合物为MgS,由镁离子与硫离子构成;⑦元素单质为Cl2,原子之间形成1对共用电子对;②元素单质为N2,原子之间形成3对共用电子对;
(4)高氯酸是最强的酸;金属性越强,最高价氧化物的水化物的碱性越强;同周期自左而右元素非金属性增强;
(5)⑨元素与③元素形成化合物为KF,由钾离子与氟离子构成,用K、F原子电子式表示其形成过程.
解答:
解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)稀有气体Ar化学性质最不活泼;④为Mg,原子核外有3个电子层,各层电子数为2、8、2,原子结构示意图为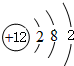 ;⑤为Cl,其离子质子数为17,核外电子数为18,各层电子数为2、8、8,离子结构示意图为
;⑤为Cl,其离子质子数为17,核外电子数为18,各层电子数为2、8、8,离子结构示意图为 ;⑨为K,其离子质子数为19,核外电子数为18,各层电子数为2、8、8,离子结构示意图为
;⑨为K,其离子质子数为19,核外电子数为18,各层电子数为2、8、8,离子结构示意图为 ,
,
故答案为:Ar;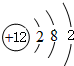 ;
; ;
; ;
;
(2)上述元素中Al的氢氧化物--氢氧化铝为两性氧化物,铝与氢氧化钾反应生成偏铝酸钾与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)④元素与⑦元素形成化合物为MgCl2,由镁离子与氯离子构成,电子式为: ;①元素与⑦元素形成化合物为CCl4,分子中碳原子与氯原子之间形成1对共用电子对,电子式为
;①元素与⑦元素形成化合物为CCl4,分子中碳原子与氯原子之间形成1对共用电子对,电子式为 ;④元素与⑥元素形成化合物为MgS,由镁离子与硫离子构成,电子式为
;④元素与⑥元素形成化合物为MgS,由镁离子与硫离子构成,电子式为 ;⑦元素单质为Cl2,原子之间形成1对共用电子对,电子式为
;⑦元素单质为Cl2,原子之间形成1对共用电子对,电子式为 ;②元素单质为N2,原子之间形成3对共用电子对,电子式为
;②元素单质为N2,原子之间形成3对共用电子对,电子式为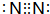 ,
,
故答案为: ;
; ;
; ;
; ;
;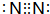 ;
;
(4)上述元素的最高价含氧酸中HClO4的酸性最强;金属性K>Mg>Al,故碱性:KOH>Mg(OH)2>Al(OH)3,同周期自左而右元素非金属性增强,故Cl的非金属性最强,
故答案为:HClO4;Al(OH)3;Cl;
(5)⑨元素与③元素形成化合物为KF,由钾离子与氟离子构成,用K、F原子电子式表示其形成过程为: ,
,
故答案为: .
.
(1)稀有气体Ar化学性质最不活泼;④为Mg,原子核外有3个电子层,各层电子数为2、8、2,原子结构示意图为
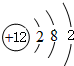 ;⑤为Cl,其离子质子数为17,核外电子数为18,各层电子数为2、8、8,离子结构示意图为
;⑤为Cl,其离子质子数为17,核外电子数为18,各层电子数为2、8、8,离子结构示意图为 ;⑨为K,其离子质子数为19,核外电子数为18,各层电子数为2、8、8,离子结构示意图为
;⑨为K,其离子质子数为19,核外电子数为18,各层电子数为2、8、8,离子结构示意图为 ,
,故答案为:Ar;
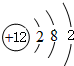 ;
; ;
; ;
;(2)上述元素中Al的氢氧化物--氢氧化铝为两性氧化物,铝与氢氧化钾反应生成偏铝酸钾与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)④元素与⑦元素形成化合物为MgCl2,由镁离子与氯离子构成,电子式为:
 ;①元素与⑦元素形成化合物为CCl4,分子中碳原子与氯原子之间形成1对共用电子对,电子式为
;①元素与⑦元素形成化合物为CCl4,分子中碳原子与氯原子之间形成1对共用电子对,电子式为 ;④元素与⑥元素形成化合物为MgS,由镁离子与硫离子构成,电子式为
;④元素与⑥元素形成化合物为MgS,由镁离子与硫离子构成,电子式为 ;⑦元素单质为Cl2,原子之间形成1对共用电子对,电子式为
;⑦元素单质为Cl2,原子之间形成1对共用电子对,电子式为 ;②元素单质为N2,原子之间形成3对共用电子对,电子式为
;②元素单质为N2,原子之间形成3对共用电子对,电子式为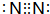 ,
,故答案为:
 ;
; ;
; ;
; ;
;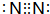 ;
;(4)上述元素的最高价含氧酸中HClO4的酸性最强;金属性K>Mg>Al,故碱性:KOH>Mg(OH)2>Al(OH)3,同周期自左而右元素非金属性增强,故Cl的非金属性最强,
故答案为:HClO4;Al(OH)3;Cl;
(5)⑨元素与③元素形成化合物为KF,由钾离子与氟离子构成,用K、F原子电子式表示其形成过程为:
 ,
,故答案为:
 .
.
点评:本题考查元素周期律与元素周期律,侧重对常用化学用语考查,注意掌握用电子式表示化学键或物质的形成过程.

练习册系列答案
相关题目
电负性大小顺序错误的是( )
| A、H>Li | B、As<P |
| C、Si>C | D、Ca<Al |
 “人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简
“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
| A、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、该分子中的所有碳原子不可能共平面 |
| D、1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |