题目内容
为测定一种复合氧化物型的磁性粉末的组成,称取12.52g样品,将其全部溶于过量稀硝酸后,配成100mL溶液.取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干得BaSO4 4.66g.在余下的50mL溶液中加入少许KSCN溶液,呈红色,如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧得3.2g固体.
(1)计算磁性粉末材料中含氧元素的质量分数.
(2)确定该材料的化学式.
(1)计算磁性粉末材料中含氧元素的质量分数.
(2)确定该材料的化学式.
考点:复杂化学式的确定
专题:计算题
分析:根据题意可知4.66g固体是硫酸钡的质量,再计算出其中的钡元素的质量,3.20g固体是Fe2O3的质量,计算出其中的铁元素的质量,混合氧化物中氧元素的质量=12.52g-钡元素的质量×2-铁元素的质量×2,再用氧元素的质量除以12.52g,求化学式时根据各元素的质量除以相对原子质量,求出原子个数比来.
解答:
解:(1)混合氧化物加入硫酸钾溶液得到白色沉淀,硫酸盐只有硫酸钡不溶,所以4.66g固体是硫酸钡的质量,则硫酸钡中钡元素的质量:4.66g×
×100%=2.74g,混合氧化物中加入氢氧化钠得到红褐色沉淀,红褐色沉淀只有氢氧化铁,所以3.20g是Fe2O3的质量,则Fe2O3中铁元素的质量:3.20g×
×100%=2.24g,所以氧元素质量:12.52g-2.74g×2-2.24g×2=2.56g,所以氧元素质量分数为
×100%=20.45%,
答:磁性粉末材料中含氧元素的质量分数为20.45%;
(2)由钡元素质量为:2.74g,铁元素质量为:2.24g,氧元素质量为:2.65g,所以钡、铁、氧原子个数比为:
:
:
=1:2:4 所以化学式为:BaFe204或BaO?Fe203.
答:化学式为BaFe204或BaO?Fe203.
| 137 |
| 233 |
| 112 |
| 160 |
| 2.56 |
| 12.52 |
答:磁性粉末材料中含氧元素的质量分数为20.45%;
(2)由钡元素质量为:2.74g,铁元素质量为:2.24g,氧元素质量为:2.65g,所以钡、铁、氧原子个数比为:
| 2.74 |
| 137 |
| 2.24 |
| 56 |
| 2.56 |
| 16 |
答:化学式为BaFe204或BaO?Fe203.
点评:本题考查化学式的计算方法,解答本题的关键是要知道4.66g固体是硫酸钡的质量,3.20g固体是氢氧化铁的质量.

练习册系列答案
相关题目
将1.5mol Ba(OH)2溶液逐滴滴入明矾溶液中:①当OH-刚好将溶液中的Al3+沉淀时;②当全部Ba2+刚好将溶液中的SO42-沉淀时.两种情况下,生成沉淀的物质的量分别为( )
| A、2mol、3mol |
| B、2mol、1mol |
| C、1.5mol、1.5mol |
| D、2.5mol、1.5mol |
下列几种说法中正确的是( )
| A、摩尔是化学上常用的一个物理量 |
| B、某物质含有6.02×1023个微粒,含有这个数目微粒的物质一定是1mol |
| C、1摩尔氢气分子可以表示为1molH2 |
| D、硫酸的摩尔质量为98g |
下列实验操作现象与图象所示不相对应的是( )
A、 往AlCl3溶液中逐滴加入NaOH溶液至过量 |
B、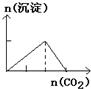 往澄清石灰水中缓慢通入CO2气体至过量 |
C、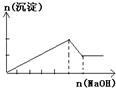 往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量 |
D、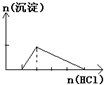 往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量 |
下列各组离子在水溶液中不能大量共存的是( )
| A、H+ K+ Cl- NO3- |
| B、K+ Al3+ Cl- CO32- |
| C、K+ Na+ CO32- NO3- |
| D、Al3+ Cu2+ SO42- Cl- |

 二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:
二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:

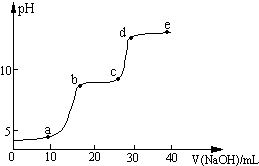 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.