题目内容
11.①pM2.5 纳入我国的空气质量报告,pM2.5 指的是D;A.CO2 B.N2 C.NO2 D.直径非常小的可吸入颗粒
②空气污染指数是根据空气中二氧化硫(填“二氧化碳”、“二氧化硫”或“甲醛”)、二氧化氮和可吸入颗粒等污染物的浓度计算出来的数值.
分析 ①PM2.5指细颗粒物,属于可吸入颗粒物;
②空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等.
解答 解:(1)①PM2.5指细颗粒物,属于可吸入颗粒物,细颗粒物指环境空气中空气动力学当量直径小于等于 2.5 微米的颗粒物,
故答案为:D;
②空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,故二氧化硫为空气质量污染指数,
故答案为:二氧化硫.
点评 本题考查环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
1.某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
Ⅰ.合成苯甲酸甲酯粗产品在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g•cm-3),再小心加入
3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是催化剂、吸水剂;
(2)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH C6H5COOCH3+H218O.
C6H5COOCH3+H218O.
(3)甲和乙两位同学分别设计了如图1所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).
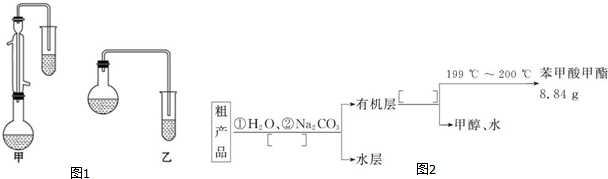
根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(4)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(5)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图2流程图进行精制,请在流程图中方括号内填入操作方法的名称.
(6)通过计算,苯甲酸甲酯的产率为65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是催化剂、吸水剂;
(2)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH
 C6H5COOCH3+H218O.
C6H5COOCH3+H218O.(3)甲和乙两位同学分别设计了如图1所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).

根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(4)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
Ⅱ.粗产品的精制
(5)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图2流程图进行精制,请在流程图中方括号内填入操作方法的名称.
(6)通过计算,苯甲酸甲酯的产率为65%.
6.下列关于氧化还原反应的说法正确的是( )
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 强氧化剂与强还原剂不一定能发生氧化还原反应 | |
| D. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 |
3.下列物质的溶解度随温度的升高而减少的是( )
| A. | KNO3 | B. | Ca(OH)2 | C. | BaSO4 | D. | AgCl |