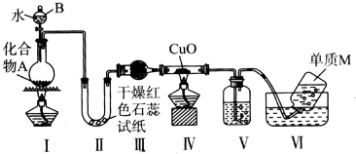
题目内容
17.有关能量的判断或表示方法正确的是( )| A. | 反应A(g)+B(g)═2C(s)可以自发进行,则其必为放热反应 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
分析 A、反应A(g)+B(g)═2C(s)为熵减的反应;
B、从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知,石墨的能量低于金刚石;
C、等质量的硫蒸汽的能量高于固态硫;
D、燃烧热是25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.
解答 解:A、反应A(g)+B(g) 2C(s)可以自发进行,由于△S<0,则其必为放热反应,故A正确;
2C(s)可以自发进行,由于△S<0,则其必为放热反应,故A正确;
B、石墨转化成金刚石为吸热反应,故金刚石的能量高,不稳定,故B错误;
C、等质量时,气态硫的能量比固态硫的高,所以完全燃烧时,气态物质放出的热量多,故C错误;
D、燃烧热是指在一定压强下,1 mol的可燃物完全燃烧生成稳定的氧化物的时候所放出的热量.而这个反应中的水是气态,故D错误.
故选A.
点评 本题考查了反应能否自发进行的相关判断、反应热的大小比较和燃烧热的概念等,要把握住概念的要点和关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
| A. | 实验③说明KI被氧化 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 实验①证明Cl-具有还原性 | |
| D. | 上述实证明氧化性:ClO3->Cl2>I2 |
12.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A. | pH=1的硝酸溶液加水稀释,水的电离平衡向右移动 | |
| B. | 合成氨工作中使用铁触媒作催化剂 | |
| C. | 饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 | |
| D. | 热的纯碱溶液去油污效果好 |
2.若某地每升海水中含钠元素11.5g,则该海水中氯化钠(设钠都以氯化钠的形式存在)的含量为( )
| A. | 23g/L | B. | 27.2g/L | C. | 29.25g/L | D. | 32.4g/L |
17.下列说法正确的是( )
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 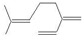 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
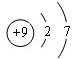 .
.