题目内容
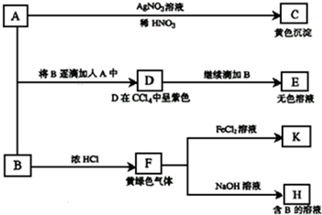
8.已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.
下列判断不正确的是( )
| A. | 实验③说明KI被氧化 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 实验①证明Cl-具有还原性 | |
| D. | 上述实证明氧化性:ClO3->Cl2>I2 |
分析 ①向KClO3晶体中滴加浓盐酸,产生黄绿色气体,应为Cl2,说明Cl-被氧化,发生KClO3+6HCl=3Cl2↑+KCl+3H2O;
②向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,发生2I-+Cl2=I2+2Cl-,
氧化还原反应中,氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,以此解答该题.
解答 解:A.向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,不能说明KI没有被氧化,故A错误;
B.向NaI溶液中通入少量实验①产生的气体,溶液变黄色,生成I2,可使淀粉KI试纸变蓝,发生2I-+Cl2=I2+2Cl-,氧化剂与还原剂的物质的量之比为1:2,故B正确;
C.向KClO3晶体中滴加浓盐酸,产生黄绿色气体,应为Cl2,发生KClO3+6HCl=3Cl2↑+KCl+3H2O,说明Cl-被氧化,证明Cl-具有还原性,故C正确;
D.根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,则由反应①可知氧化性KClO3>Cl2,由反应②可知Cl2>I2,则可得氧化性ClO3->Cl2>I2,故D正确.
故选A.
点评 本题考查氯气的化学性质,题目难度不大,在学习中要注意比较氧化性、还原性的方法,氧化还原反应电子守恒的利用等问题.

练习册系列答案
相关题目
16.下列物质中属于电解质的是( )
| A. | 氯化钠溶液 | B. | 金属铜 | C. | 二氧化硫 | D. | 硫酸铜 |
3.下列说法不正确的是( )
| A. | 化学电池可以将化学能转化为电能 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法 | |
| C. | 冶炼Na、Mg、Al等活泼金属时,可选择电解法 | |
| D. | 水汽化需要吸收能量,所以水汽化属于吸热反应 |
17.有关能量的判断或表示方法正确的是( )
| A. | 反应A(g)+B(g)═2C(s)可以自发进行,则其必为放热反应 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
9.表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述错误的是( )
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
 CCH3CH2OHD
CCH3CH2OHD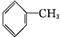 ECH3COOH
ECH3COOH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.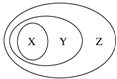 如表所列物质或概念间的从属关系符合如图所示关系的是( )
如表所列物质或概念间的从属关系符合如图所示关系的是( )