题目内容
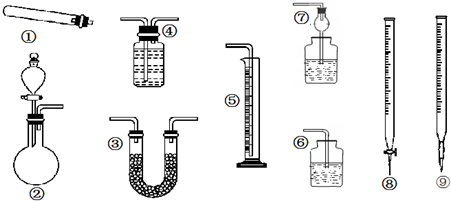
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
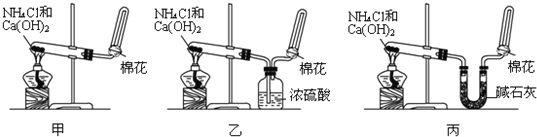
(1)三位同学制取氨气的化学方程式为:
(2)三位同学都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是 填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是 (用化学方程式表示).
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是 (填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4CL固体代替NH3? (填“能”或“不能”).
II资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.
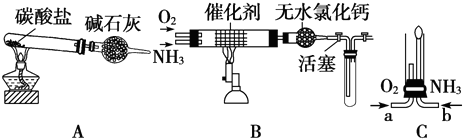
(6)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是 .
(7)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该反应的化学方程式是 .
(8)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ,其理由是 .
②氨气燃烧的化学方程式是 .

(1)三位同学制取氨气的化学方程式为:
(2)三位同学都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是
II资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.

(6)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是
(7)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是
(8)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是
②氨气燃烧的化学方程式是
考点:氨的制取和性质
专题:氮族元素
分析:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)氨气能与硫酸反应而被硫酸吸收;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性;
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,可以用碱石灰除杂;
(6)碱石灰可以吸收酸性气体,并用于干燥氨气;
(7)NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2
4NO+6H2O,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体;
(8)①若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和水.
| ||
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)氨气能与硫酸反应而被硫酸吸收;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性;
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,可以用碱石灰除杂;
(6)碱石灰可以吸收酸性气体,并用于干燥氨气;
(7)NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2
| ||
| △ |
(8)①若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和水.
解答:
解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,故答案为:氨气的密度比空气小,且氨气极易溶于水;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,反应方程式为:2NH3+H2SO4=(NH4)2SO4;
故答案为:乙,2NH3+H2SO4=(NH4)2SO4;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
故答案为:蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
(5)碳酸氢铵受热分解生成氨气、水和二氧化碳.甲收集到的是混合气体,得不到纯净氨气,乙分解得到二氧化碳、氨气和水蒸气通过浓硫酸氨气被吸收得不到氨气,丙分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气,该装置中的NH4HCO3固体不能用NH4CL固体代替NH3 ,氯化铵分解生成的氨气和氯化氢在试管口处会重新反应生成氯化铵;
故答案为:丙,不能;
(6)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,其分解产生的混合气体通过碱石灰后,CO2和H2O被吸收,可得到纯净的NH3;
故答案为:吸收水和二氧化碳;
(7)NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2
4NO+6H2O,通过无水CaCl2后,未反应完的NH3和生成的H2O被吸收,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体,方程式为:2NO+O2═2NO2;
故答案为:4NH3+5O2
4NO+6H2O;2NO+O2═2NO2;
(8)①由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2
2N2+6H2O(O2置换N2).
故答案为:先通O2,后通NH3;若先通NH3,氨气在空气中不能燃烧,逸出造成环境污染;4NH3+3O2
2N2+6H2O.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,故答案为:氨气的密度比空气小,且氨气极易溶于水;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,反应方程式为:2NH3+H2SO4=(NH4)2SO4;
故答案为:乙,2NH3+H2SO4=(NH4)2SO4;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
故答案为:蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满;
(5)碳酸氢铵受热分解生成氨气、水和二氧化碳.甲收集到的是混合气体,得不到纯净氨气,乙分解得到二氧化碳、氨气和水蒸气通过浓硫酸氨气被吸收得不到氨气,丙分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气,该装置中的NH4HCO3固体不能用NH4CL固体代替NH3 ,氯化铵分解生成的氨气和氯化氢在试管口处会重新反应生成氯化铵;
故答案为:丙,不能;
(6)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,其分解产生的混合气体通过碱石灰后,CO2和H2O被吸收,可得到纯净的NH3;
故答案为:吸收水和二氧化碳;
(7)NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(8)①由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
②NH3在纯氧中燃烧的化学方程式为:4NH3+3O2
| ||
故答案为:先通O2,后通NH3;若先通NH3,氨气在空气中不能燃烧,逸出造成环境污染;4NH3+3O2
| ||
点评:本题为信息给予题,考查氨气的有关性质,做题时注意题中“氨气可在纯氧中安静燃烧…”这一重要信息,结合氨气的性质解答问题,题目难度中等.

练习册系列答案
相关题目
对于某些离子的检验及结论一定正确的是( )
| A、取样,加入紫色石蕊,溶液变红,一定有H+ |
| B、取样,加入氯化钡溶液有白色沉淀产生.再加盐酸,沉淀不消失,一定有SO42- |
| C、取样,加入硝酸银有白色沉淀,一定有Cl- |
| D、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
 (1)按要求写出下列反应方程式:
(1)按要求写出下列反应方程式: