题目内容
15.下列反应中必须加入还原剂才能进行的是( )| A. | MnO4-→Mn2+ | B. | H2O2→H2O | C. | H2→H2O | D. | Zn→Zn2+ |
分析 必须加入还原剂才能进行,则选项中为氧化剂发生的还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.Mn元素的化合价降低,需要加还原剂发生,故A选;
B.O元素的化合价升高,可发生自身氧化还原反应,故B不选;
C.H元素的化合价升高,可加氧化剂发生,故C不选;
D.Zn元素的化合价升高,可加氧化剂发生,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.1000ml某无色待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(所加试剂均过量):(已知:NH4++OH-(浓)=NH3↑+H2O)
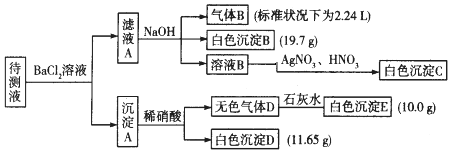
(1)原溶液中肯定存在的离子是(除Na+)CO32-、HCO3-、SO42-、K+、NH4+,肯定不存在的离子是Fe3+、Ba2+.
(2)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.写出沉淀A溶于稀硝酸的离子方程式:BaCO3+2H+=Ba2++H2O+CO2↑.
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次.
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、CO32-、HCO3-、SO42- |

(1)原溶液中肯定存在的离子是(除Na+)CO32-、HCO3-、SO42-、K+、NH4+,肯定不存在的离子是Fe3+、Ba2+.
(2)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.写出沉淀A溶于稀硝酸的离子方程式:BaCO3+2H+=Ba2++H2O+CO2↑.
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是沿玻璃棒继续向漏斗中加水至刚好浸没沉淀,待水自然流下后重复操作2-3次.
3.以下转化不能一步反应实现的是( )
| A. | Al2O3-->Al(OH)3 | B. | Cu-->CuCl2 | C. | Fe-->FeCl2 | D. | Na-->NaOH |
5.某溶液中有Ba2+、Mg2+、Ag+,现用①KOH溶液,②K2SO4溶液,③KCl溶液,将三种离子逐一沉淀并分离的过程中,用到的分离方法及次数分别是( )
| A. | 洗涤,2次 | B. | 过滤,2次 | C. | 分液,3次 | D. | 过滤,3次 |
 氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.
氰、硫、碳的氧化物有多种,其中S02和N0x都是大气污染物,对它们的研究有助于空气的净化.

 .
. .
.