题目内容
1. A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)某同学根据上述信息,所画的B电子排布图

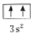 违背了泡利原理.
违背了泡利原理.(3)F位于Ⅷ族d区,其基态原子的电子有28种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
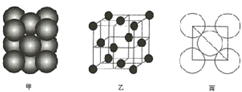
(5)若某金属单质晶体中原子的堆积方式如图甲所示,其晶数特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,则晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为四种基本堆积方式的面心立方最密堆积.
分析 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子最外层电子数是其电子总数的$\frac{1}{3}$,核外电子排布为1s22s22p63s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F处于第四周期,且在第10列,则F为Ni,据此解答.
解答 解:A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子最外层电子数是其电子总数的$\frac{1}{3}$,核外电子排布为1s22s22p63s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F处于第四周期,且在第10列,则F为Ni.
(1)A为N,能量最高的电子为2p电子,其电子云在空间有3个方向,p轨道为纺锤形,故答案为:3;纺锤形;
(2)由泡利原理可知,电子在同一轨道内的自旋方向应相反,B基态原子的核外电子排布图中3s上的两个电子自旋方向相同,则违反了泡利原理,
故答案为:泡利;
(3)F为Ni,在第四周期第Ⅷ族,最后填充的为d电子,在d区,核外电子数为28,有28种运动状态不同的电子,
故答案为:Ⅷ;d;28;
(4)PCl3中P原子孤电子对数为1,成键数为3,则为sp3杂化,空间构型为三角锥形,E为K,检验K元素应利用焰色反应,
故答案为:sp3;三角锥形;焰色反应;
(5)由晶胞结构可知,以顶点原子研究,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方最密堆积,
故答案为:12;面心立方最密堆积.
点评 本题是对物质结构与性质的考查,难度中等,注意原子结构知识在元素推断中的重要性,学生应熟悉电子的排布、空间构型、杂化等知识点,识记中学常见的晶胞结构.

 期末集结号系列答案
期末集结号系列答案| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
| A. | 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl->c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
| A. | 27% | B. | 52% | C. | 40% | D. | 无法计算 |
| A. | 1molH2和1mol I2完全反应放出4.5kJ热量 | |
| B. | 1个氢分子和1个碘分子完全反应放出9kJ热量 | |
| C. | 1molH2和1mol I2完全反应生成气态HI放出9kJ热量 | |
| D. | 0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量 |
| A. | 将海水蒸馏淡化为饮用水 | |
| B. | 四氯化碳萃取碘水中的碘 | |
| C. | 过滤除去粗盐溶液中的不溶性杂质 | |
| D. | 三氯化铁溶液滴入沸水中可制得氢氧化铁胶体 |


 (6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.
(6)工业上可回收CO作燃料.如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的负(填“正”或“负”)极,写出B极电极反应式:2CO2+O2+4e-=2CO32-.