题目内容
6.2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由如表中的离子形成的:| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
分析 ①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+产生的白色沉淀是氢氧化铝沉淀,而氢氧化铝沉淀只溶于强碱,所以E是氢氧化物;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃),说明B、C中含有K+,其他物质中不含K元素;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,说明A中含有HCO3-,则A是NaHCO3,C、D中含有SO42-,所以C是KAl(SO4)2,D是CuSO4,E是NaOH;
⑤将B、D两溶液混合,未见沉淀或气体生成,所以B是KNO3,然后结合化学用语及反应原理来解答.
解答 解:由①可知D中含有Cu2+;根据②可知C中含有Al3+产生的白色沉淀是氢氧化铝沉淀,而氢氧化铝沉淀只溶于强碱,所以E是氢氧化物;③说明B、C中含有K+,其他物质中不含K元素;④说明A中含有HCO3-,则A是NaHCO3,C、D中含有SO42-,则C是KAl(SO4)2,D是CuSO4,E是NaOH;⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3,
(1)由以上分析可知A、B、C、D分别是NaHCO3、KNO3、KAl(SO4)2、CuSO4,
故答案为:NaHCO3;KNO3;KAl(SO4)2;CuSO4;
(2)NaHCO3与NaOH反应生成碳酸钠和水,溶液蒸干后,仅得到一种化合物是碳酸钠,所以得到的化合物为Na2CO3,
故答案为:Na2CO3;
(3)C与E反应先生成氢氧化铝沉淀,后氢氧化铝逐渐溶解,反应的离子方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(4)C用作净水剂是因为铝离子水解生成氢氧化铝胶体的缘故,反应的离子方程式为:Al3++3H2O═Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O═Al(OH)3(胶体)+3H+.
点评 本题考查物质的推断与性质判断,为高频考点,题目难度中等,明确离子之间的反应、现象与物质推断的关系为解答的关键,试题侧重分析与推断能力的考查.

 名校课堂系列答案
名校课堂系列答案| C(H+)mol•L-1 | C(OH-)mol•L-1 | PH | |
| 溶液1 | 1×10-4 | 1×10-10 | 4 |
| 溶液2 | 1×10-7 | 1×10-7 | 7 |
| 溶液3 | 1×10-9 | 1×10-5 | 9 |

图中:①为氯气的发生装置; ②的试管里盛有15mL 30% KOH溶液,并置于水浴中;
③的试管里盛有15ml8%NaOH溶液,并置于冰水浴中; ④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填写下列编号字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:①制取温度不同;②制取时碱的浓度也不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填写编号字母);冷却后从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O,
实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变黄绿色 |
| A. | 硅酸、氯化铁溶液均为胶体 | B. | 水玻璃、明矾溶液均为混合物 | ||
| C. | 硫酸、纯碱、NaCl分别属于酸、碱、盐 | D. | KCl和Cu均属于电解质 |
| A. | 某蓝色溶液中加NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ | |
| B. | 某溶液中加BaCl2溶液,生成白色沉淀,继续滴加稀硝酸沉淀不溶解,说明原溶液中有SO42- | |
| C. | 某溶液中加硝酸银溶液,生成白色沉淀,继续滴加稀硝酸有部分沉淀不溶解,说明原溶液中一定有Cl- | |
| D. | 某溶液中加稀硫酸溶液生成无色无味气体,该气体能使澄清石灰水变浑浊,说明原溶液中一定含有CO32- |

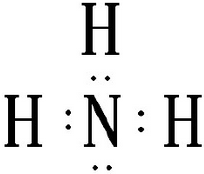 .向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
.向饱和食盐水中应先通入气体氨气(填气体名称),再通入气体O=C=O(填气体的结构式)才能得到物质D,其原因是先通氨气使溶液碱性增强,能溶解更多的二氧化碳,生成较多的碳酸氢钠,使碳酸氢钠晶体析出.
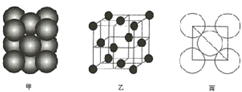 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
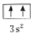 违背了泡利原理.
违背了泡利原理.