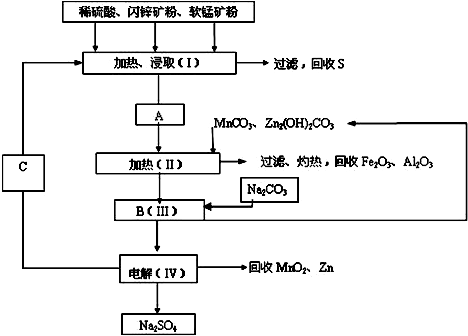
题目内容
25mL 0.1mol/L盐酸与15mL 0.1ml/L氢氧化钠溶液反应后PH为 .
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:n(H+)=0.025L×0.1mol/L=0.0025 mol,n(OH-)=0.015L×0.1mol/L=0.0015mol,酸过量,反应后溶液呈酸性,计算反应后的c(H+),带入pH=-lgc(H+)可计算pH.
解答:
解:n(H+)=0.025L×0.1mol/L=0.0025 mol,n(OH-)=0.015L×0.1mol/L=0.0015mol,
酸过量,反应后溶液呈酸性,反应后所得溶液的c(H+)=
=0.025mol/L,
则反应后pH=-lgc(H+)=1.6,
故答案为:1.6.
酸过量,反应后溶液呈酸性,反应后所得溶液的c(H+)=
| (0.0025-0.0015)mol |
| 0.025L+0.015L |
则反应后pH=-lgc(H+)=1.6,
故答案为:1.6.
点评:本题考查酸碱混合的计算,难度不大,注意酸碱物质的量的计算和过量问题,把握相关计算公式.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
对于蒸馏实验中的下列说法错误的是( )
| A、为了更好地控制蒸汽温度,应将温度计向下插入接近液面处 |
| B、为了防止暴沸,在对液体混合物进行蒸馏操作时应该加入沸石 |
| C、为了保证冷凝效果,冷凝水应从冷凝管的下口流入上口流出 |
| D、牛角管的作用是使冷凝后的液体沿着其方向流入锥形瓶 |
下列说法正确的是( )
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、水分子可表示为H-O-H,分子中键角为180. |
| C、H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时消耗能量为2×463KJ |
| D、元素周期表中的第ⅠA族和第ⅦA族元素的原子间可以形成共价键 |
下列各组离子可以在溶液中大量共存的是( )
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
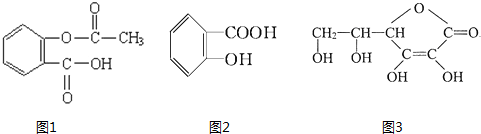
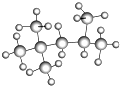 的名称(系统命名法)是
的名称(系统命名法)是