题目内容
2.工业上制取硝酸铵的流程图如下,请回答下列问题: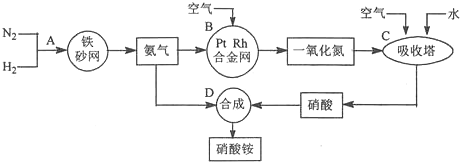
(1)合成氨的工业设备名称是合成塔,设备中设置热交换器的目的是利用余热,节约能源;此生产过程中,N2与H2合成NH3所用的催化剂是铁触媒;生产中原料气必须进行脱硫,目的是防止催化剂中毒.
(2)吸收塔中的反应为4NO+3O2+2H2O=4HNO3,从生产流程看,吸收塔中需要补充空气,其原因是可使NO循环利用,提高原料利用率.
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH═2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2═7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)═CO2(g)+N2(g)+2H2O(g)△H=+867kJ•mol-1(NO也有类似的反应)
上述三种方法中方法一最大的缺点是单独的NO不能被吸收;方法三和方法二相比,优点是甲烷比氨价格便宜,缺点是耗能高.
(4)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的54.4%(保留三位有效数值).
分析 (1)合成氨反应要用铁触媒作催化剂,对原料气进行除杂,防止催化剂中毒.
(2)吸收塔中发生的反应是NO与O2和水反应生成HNO3,向吸收塔中不断通入空气,能使NO反应完全,可从源头上减少NO污染.
(3)绿色化学要求从根本上减少或杜绝污染,提高原料利用率,节约能耗.
(4)化肥厂制硝酸铵:HNO3+NH3=NH4NO3.根据氮元素守恒可知,可由NH3得NO产率,再由NO制得HNO3的产率可计算得到HNO3的量;总耗NH3包括制硝酸消耗的以及与硝酸反应的总量.
解答 解:(1)在合成氨的设备(合成塔)中,用到的催化剂是铁砂网,硫可使催化剂中毒(降低催化剂活性),设置热交换器的目的是利用余热,节约能源;
故答案为:合成塔;利用余热,节约能源;铁砂网(或铁或铁触媒);防止催化剂中毒.
(2)在合成硝酸的吸收塔中不断通入空气,目的是提供充足的氧气,以便使NO循环利用,全部转化成硝酸;
故答案为:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3);可使NO循环利用,提高原料利用率.
(3)根据“绿色化学”要求,从根本上减少或杜绝污染,尽可能使原料和利用率提高来看,符合绿色的要求.题中方法一碱吸收法中,NO与碱不反应,因此方法一最大的缺点就是对单独的NO污染物没法吸收;方法三与方法二相比较而言,优点是原料甲烷比氨的单价要便宜,方法三更经济,但是甲烷吸收法的反应是吸热的,而氨还原法的反应是放热的,因此方法三的缺点是耗能大.
故答案为:单独的NO不能被吸收;甲烷比氨价格便宜;耗能高.
(4)由NH3制NO的产率是94%,NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可制得硝酸1mol×94%×89%=0.8366mol;由HNO3+NH3=NH4NO3可知,该反应消耗的氨气的量为0.8366mol;制HNO3所用的NH3的量为1mol,总耗的氨气量为1mol+0.8366mol=1.8366mol,则制HNO3所用的NH3的质量占总耗NH3质量的百分数为:$\frac{1mol}{1mol+0.8366mol}$≈54.4%(保留三位有效数字);
故答案为:54.4.
点评 本题主要考察工业制硝酸的相关流程,联系现在绿色化学的理念,综合性较强.

| A. | 乙醚 | B. | 甲醚 | C. | 乙醛 | D. | 乙醇 |
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. |  与 与 |
| A. | 1mol葡萄糖最多可以与5mol金属钠反应放出氢气 | |
| B. | 1mol葡萄糖最多可以与5mol乙酸发生取代反应 | |
| C. | 能发生银镜反应 | |
| D. | 可与小苏打溶液反应冒出气泡 |
| A. | C6H12O6 | B. | (C6H10O5)n | C. | C12H22O11 | D. | CF2Cl2 |
| A. |  分离FeCl3溶液和蔗糖溶液 | B. |  称量8.55g氯化钠固体 | ||
| C. | 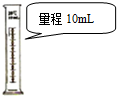 量取9.50 mL水 | D. | 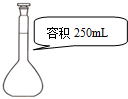 配制240 mL 0.1mol/L的NaCl溶液 |
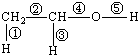 (1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答:
(1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答: