题目内容
9.钒(23V)广泛用于催化及钢铁工业,我国四川的攀枝花和河北的承德有丰富的钒矿资源.回答下列问题:(1)钒原子的外围电子排布式为3d34s2,所以在元素周期表中它应位于VB族.
(2)V2O5常用作SO2转化为SO3的催化剂.当SO2气态为单分子时,分子中S原子δ电子对有3对,S原子的杂化轨道类型为sp2,分子的立体构型为V形;SO3的三聚体环状结构如图1所示,此氧化物的分子式应为S3O9,该结构中S-O键长有a、b两类,b的键长大于a的键长的原因为形成b键的氧原子与两个S原子结合,作用力较小;
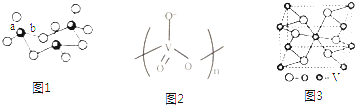
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子中V的杂化轨道类型为sp3;以得到偏钒酸钠,其阴离子呈如图2所示的无限链状结构,则偏钒酸钠的化学式为NaVO3;
(4)钒的某种氧化物晶胞结构如图3所示.该氧化物的化学式为VO2,若它的晶胞参数为xnm,则晶胞的密度为$\frac{1.66×1{0}^{19}}{{N}_{A}{x}^{3}}$g•cm-3.
分析 (1)由题意知,钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第4周期ⅤB族,根据核外电子的轨道能量排布顺序知,1s<2s<2p<3s<3p<4s<3d<4p,因此推断其电子排布式为1s22s22p63s23p63d34s2,注意由于4s轨道能量比3d轨道能量低,因此先排4s轨道,因此其价层电子排布式为3d34s2,以此书写电子排布式;
(2)SO2分子中S原子形成2个δ键,孤电子对数为$\frac{6-2×2}{2}$=1,SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,SO3的三聚体中S原子形成4个δ键,以此判断空间构型和杂化类型;SO3的三聚体属于分子结构,一个分子中含有3个S原子和9个O原子,键长越大键能越小;
(3)VO43-中,V形成4个δ键,孤电子对数为$\frac{5+3-4×2}{2}$=0,为正四面体结构,由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,以此判断形成的化合物的化学式;
(4)由晶胞可知,V位于顶点和体心,O有4个位于面心,2个位于体心,根据晶胞$ρ=\frac{m}{V}$计算.
解答 解:(1)由题意知,钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第4周期ⅤB族,根据核外电子的轨道能量排布顺序知,1s<2s<2p<3s<3p<4s<3d<4p,因此推断其电子排布式为1s22s22p63s23p63d34s2,注意由于4s轨道能量比3d轨道能量低,因此先排4s轨道,因此其价层电子排布式为3d34s2,则电子排布式为
3d34s2,
故答案为:3d34s2;V;
(2)SO2分子中S原子形成2个δ键,孤电子对数为$\frac{6-2×2}{2}$=1,SO2分子中S原子价层电子对数是3,为V形结构,SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,则为sp2杂化;SO3的三聚体属于分子结构,一个分子中含有3个S原子和9个O原子,故分子式为S3O9,形成b键的氧原子与两个S原子结合,作用力较小,键能较小,键能越小键长越大;
故答案为:3;sp2;V形;S3O9;形成b键的氧原子与两个S原子结合,作用力较小;
(3)VO43-中,V形成4个δ键,孤电子对数为$\frac{5+3-4×2}{2}$=0,杂化方式为sp3,空间构型为正四面体结构,由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,则形成的化合物化学式为NaVO3,
故答案为:sp3;NaVO3;
(4)由晶胞可知,V位于顶点和体心,阳离子个数为1+8×$\frac{1}{8}$=2,O有4个位于面心,2个位于体心,则阴离子个数为4×$\frac{1}{2}$+2=4,阴阳离子数目之比为4:2=2:1,该氧化物的化学式为VO2;晶胞边长为xnm=x×10-7cm,晶胞体积V=10-21x3cm3,一个晶胞的质量m=$\frac{51×2+16×4}{{N}_{A}}$,则密度$ρ=\frac{m}{V}$=$\frac{\frac{166}{{N}_{A}}}{1{0}^{-21}{x}^{3}}$=$\frac{1.66×1{0}^{19}}{{N}_{A}{x}^{3}}$.
故答案为:VO2;$\frac{1.66×1{0}^{19}}{{N}_{A}{x}^{3}}$.
点评 本题综合考查物质的结构和性质,侧重于学生的分析能力的考查,注意把握杂化类型以及价层电子数的判断,难度中等.

| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1××10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-15 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子(一级电离产生的氢离子对二级电离起抑制作用).
(3)同浓度的CH3COONa、NaHCO3、Na2CO3、Na2S溶液的pH由大到小的顺序为Na2S>Na2CO3>NaHCO3>CH3COONa.
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mo-l,逆反应的活化能为Eb kJ•mol-l,则△H=-( Ea-Eb)kJ.mol-l | |
| B. | 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
| A. | “沙尘暴”属于一种自然现象,与人类活动无关 | |
| B. | 碳酸铝是一种应用很广的视频添加剂,可大量添加到馒头、面包、油条等食品中 | |
| C. | 利用垃圾发电能达到节能减排的目的 | |
| D. | 持续高温天气的出现与人类活动无关 |
| A. | 甲烷和氯气混合后光照发生反应 | B. | 乙炔和氯气的加成反应 | ||
| C. | 甲苯与等物质的量的Br2发生反应 | D. | 乙烯与水的加成反应 |
①KMnO4(H+,aq) ②品红溶液③溴水④氯水⑤Fe3+(aq)
| A. | ①③⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 只有② |
| A. | H2SiO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | HF、HCl、HBr、HI的热稳定性依次增强 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| A. | 强碱性的溶液中,Na+、S2-、[Al(OH)4]-、SO32- | |
| B. | 酸性溶液中,Fe2+、Na+、NO3-、SO42- | |
| C. | 能与铝放出H2的溶液中、K+、Cu2+、NO3-、SO42- | |
| D. | 无色溶液中Ca2+、Cu2+、ClO-、NO3- |