题目内容
19.下表是几种弱酸常温下的电离平衡常数:| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1××10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-15 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子(一级电离产生的氢离子对二级电离起抑制作用).
(3)同浓度的CH3COONa、NaHCO3、Na2CO3、Na2S溶液的pH由大到小的顺序为Na2S>Na2CO3>NaHCO3>CH3COONa.
分析 (1)酸的电离平衡常数越大,则酸的电离程度越大,其酸性越强;
(2)多元弱酸一级电离出的氢离子抑制二级电离;
(3)酸的电离平衡常数越大,酸的酸性越强,其对应酸根离子水解程度越小,相同浓度的钠盐溶液pH越小.
解答 解:(1)相同条件下,酸的电离平衡常数越大,其酸性越强,多元弱酸的酸性决定于一级电离,所以四种酸的酸性H3PO4>CH3COOH>H2CO3>H2S,故答案为:H3PO4>CH3COOH>H2CO3>H2S;
(2)多元弱酸一级电离产生的氢离子会抑制二级电离,所以多元弱酸的二级电离程度远小于一级电离,
故答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子(一级电离产生的氢离子对二级电离起抑制作用);
(3)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根离子越容易水解,所以同浓度的CH3COO-、HCO3-、CO32-、S2-水解能力由弱到强,溶液的碱性也由弱到强顺序为Na2S>Na2CO3>NaHCO3>CH3COONa,
故答案为:Na2S>Na2CO3>NaHCO3>CH3COONa.
点评 本题考查弱电解质的电离,为高频考点,明确电离平衡常数与酸性强弱关系、酸根离子水解程度关系是解本题关键,注意多元弱酸根离子与其对应弱酸的关系,如碳酸根离子对应的酸是碳酸氢根离子而不是碳酸,为易错点.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
4.相同温度下,两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB).下列有关说法正确的是( )
| A. | 浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 在0.1 mol•L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+) |
8.0.02mol•L-1的HCN溶液与0.02mol•L-1的NaCN溶液等体积混合,已知混合液中c(CN-)<c(Na+),则下列关系不正确的是( )
| A. | c(HCN)+c(CN-)=0.02 mol•L-1 | B. | c(Na+)>c(OH-)>c (CN-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CN-)+c(OH-) | D. | c(HCN)>c(CN-) |
 .分子个数 C.原子个数 D.气体体积
.分子个数 C.原子个数 D.气体体积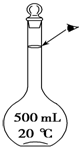 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤: