题目内容
16.下列说法正确的是( )| A. | 混合浓硫酸和乙醇时,应将乙醇慢慢注入到浓硫酸中 | |
| B. | 萃取、配制物质的量浓度的溶液都要用到玻璃棒 | |
| C. | 用丁达尔效应可鉴别溶液和胶体 | |
| D. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸 |
分析 A.与酸混合时,将密度大的液体注入密度小的液体中;
B.萃取需要分液漏斗,配制溶液需要玻璃棒搅拌、引流;
C.丁达尔现象为胶体特有的性质;
D.乙酸乙酯、乙酸均与NaOH反应.
解答 解:A.混合浓硫酸和乙醇时,应将浓硫酸慢慢注入到乙醇中,并不断搅拌,使产生的热量及时散失,故A错误;
B.萃取需要分液漏斗,配制溶液需要玻璃棒搅拌、引流,则萃取不需要玻璃棒,故B错误;
C.丁达尔现象为胶体特有的性质,则可用丁达尔效应可鉴别溶液和胶体,故C正确;
D.乙酸乙酯、乙酸均与NaOH反应,不能除杂,应选饱和碳酸钠溶液、分液除去乙酸乙酯中混有的乙酸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、混合物分离提纯、物质的鉴别等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.设 N A为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 已知 N2(g)+3H2 (g)═2NH3(g)△H=-92.4 kJ•mol-1,当有 1molNH3时,上述反应的△H 变为-46.2 kJ•mol-1 | |
| B. | 1mol 羟基(-OH)与 17gNH3所含电子数都为NA | |
| C. | 由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA | |
| D. | 常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA |
4.下列指定反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
11.下列化学用语中,说法正确的是( )
| A. | CO2分子的结构式O-C-O | B. | 乙醇的分子式C2H6O | ||
| C. | Mg2+结构示意图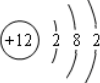 | D. | NaCl的电子式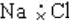 |
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族. +O2+xOH-
+O2+xOH- Fe3O4↓+S4O
Fe3O4↓+S4O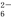 +2H2O。
+2H2O。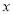 =____________.
=____________.