题目内容
4.下列指定反应的离子方程式正确的是( )| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
分析 A.反应生成氢氧化铝和碳酸氢钠;
B.漏写碳酸氢根离子与碱的反应;
C.醋酸在离子反应中保留化学式;
D.电子、电荷不守恒.
解答 解:A.向NaAlO2溶液中通入过量CO2的离子反应为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故A正确;
B.NH4HCO3溶液中加过量NaOH溶液并加热的离子反应为HCO3-+NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故B错误;
C.用CH3COOH溶解CaCO3的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.Cu溶于稀硝酸HNO3的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol/LNaCl溶液含有NA个Na+ | |
| B. | 任意条件下,16gO3所含的原子数为NA | |
| C. | 1molFe与足量稀HNO3反应,转移3NA个电子 | |
| D. | 标准状况下,22.4LSO3所含的分子数为NA |
16.下列说法正确的是( )
| A. | 混合浓硫酸和乙醇时,应将乙醇慢慢注入到浓硫酸中 | |
| B. | 萃取、配制物质的量浓度的溶液都要用到玻璃棒 | |
| C. | 用丁达尔效应可鉴别溶液和胶体 | |
| D. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸 |
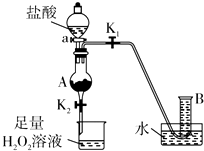 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
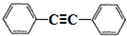 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: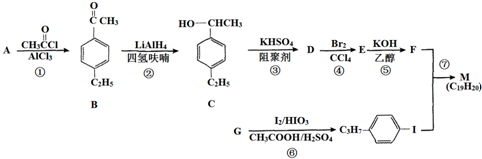
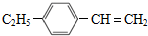 ,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;
,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;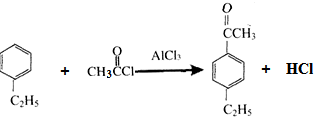 ,④的反应类型是加成反应;
,④的反应类型是加成反应;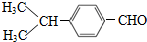 (写结构简式);
(写结构简式);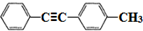 的合成路线
的合成路线 .
.
 有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系: