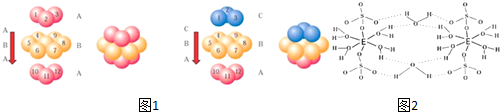
题目内容
11.下列化学用语中,说法正确的是( )| A. | CO2分子的结构式O-C-O | B. | 乙醇的分子式C2H6O | ||
| C. | Mg2+结构示意图 | D. | NaCl的电子式 |
分析 A.二氧化碳分子中含有两个碳氧双键;
B.乙醇为含有2个碳原子的饱和一元醇;
C.镁离子的核外电子总数为10,最外层含有8个电子;
D.氯化钠为离子化合物,阴离子需要标出最外层电子.
解答 解:A.CO2分子中含有两个碳氧双键,其正确的结构式为:O=C=O,故A错误;
B.乙醇分子可以看作1个羟基取代了乙烷分子中的1个H形成的,其分子式为C2H6O,故B正确;
C.镁离子的核电荷数为12,最外层达到8电子稳定结构,其正确的结构示意图为: ,故C错误;
,故C错误;
D.NaCl为离子化合物,由钠离子与氯离子构成,正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构式、分子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
1.【化学-选修3:物质结构与性质】
(1)原高碘酸盐(IO65-)、过二硫酸盐(S2O82-)、二氧化铅(PbO2)是三种具有强氧化性的物质,均能在一定条件下将Mn2+氧化为高锰酸盐.回答下列问题:
①基态锰原子能量最高能级电子排布图为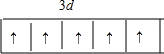 .
.
②过二硫酸根离子中两个硫原子间存在过氧键,写出过硫酸根离子的结构简式 .
.
③碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如表所示:
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(2)利用铜萃取剂M,通过如下反应实现铜离子的富集:
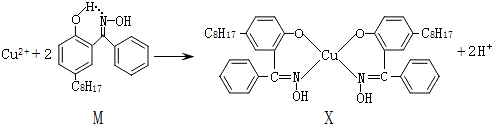
①X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
②X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
③上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键 f.氢键
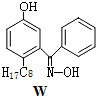
④M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
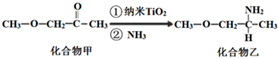
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图.化合物乙中手性碳原子有1个,化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键.化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为O>N>C.
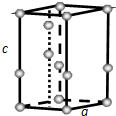
(4)常压下,水冷却至0℃以下,即可结晶成六方晶系的冰.日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737pm,菱形底边a=452pm,底面菱形的锐角是60°.则:冰的密度=ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{{a}^{2}•sin60°}$=$\frac{\frac{18×4}{6.02×1{0}^{23}}}{45{2}^{2}×737×0.866×(1{0}^{-10})^{3}}$=0.917 g/cm3(代值列计算式).
(1)原高碘酸盐(IO65-)、过二硫酸盐(S2O82-)、二氧化铅(PbO2)是三种具有强氧化性的物质,均能在一定条件下将Mn2+氧化为高锰酸盐.回答下列问题:
①基态锰原子能量最高能级电子排布图为
 .
.②过二硫酸根离子中两个硫原子间存在过氧键,写出过硫酸根离子的结构简式
 .
.③碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(2)利用铜萃取剂M,通过如下反应实现铜离子的富集:

①X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
②X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为N>O>C.
③上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键 f.氢键
④M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.

(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图.化合物乙中手性碳原子有1个,化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键.化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为O>N>C.

(4)常压下,水冷却至0℃以下,即可结晶成六方晶系的冰.日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737pm,菱形底边a=452pm,底面菱形的锐角是60°.则:冰的密度=ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{{a}^{2}•sin60°}$=$\frac{\frac{18×4}{6.02×1{0}^{23}}}{45{2}^{2}×737×0.866×(1{0}^{-10})^{3}}$=0.917 g/cm3(代值列计算式).

6.如表各组物质中,满足组内甲、乙、丙任意两种物质在一定条件下均能发生反应的是( )
| 物质组别 | 甲 | 乙 | 丙 |
| A | NH3 | O2 | HNO3 |
| B | Al | HCl | NaOH |
| C | SiO2 | NaOH | HCl |
| D | CO2 | Ca(OH)2 | NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
16.下列说法正确的是( )
| A. | 混合浓硫酸和乙醇时,应将乙醇慢慢注入到浓硫酸中 | |
| B. | 萃取、配制物质的量浓度的溶液都要用到玻璃棒 | |
| C. | 用丁达尔效应可鉴别溶液和胶体 | |
| D. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸 |
20.第4周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )
| A. | 原子半径比钾的原子半径大 | B. | 氯化物难溶于水 | ||
| C. | 其氢氧化物的碱性比NaOH强 | D. | 碳酸盐难溶于水 |