题目内容
NaHCO3盐溶液中的粒子浓度关系.
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:碳酸氢钠溶液中存在碳酸氢钠的电离、水的电离、碳酸氢根离子的电离及碳酸氢根离子的水解,写出电离方程式、水解方程式,然后根据盐的水解原理、电荷守恒判断溶液中各离子浓度大小.
解答:
解:碳酸钠为强电解质,在溶液中电离出Na+和HCO3-:NaHCO3═Na++HCO3-,碳酸氢根离子在溶液中存在电离平衡和水解平衡:HCO3-?CO32-+H+、HCO3-+H2O?H2CO3+OH-,由于HCO3-的水解程度大于HCO3-电离程度,碳酸钠溶液显示碱性,c(OH-)>c(H+)、c(HCO3-)>c(H2CO3)>c(CO32-);由于氢氧根离子来自水的电离和碳酸氢根离子的水解,则c(OH-)>c(H2CO3),溶液中粒子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-),
答:NaHCO3溶液中的粒子浓度关系为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-).
答:NaHCO3溶液中的粒子浓度关系为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-).
点评:本题考查了离子浓度大小比较的方法,题目难度中等,注意掌握盐的水解原理,明确判断溶液中离子浓度大小的常用方法,注意电荷守恒、物料守恒、盐的水解原理的应用.

练习册系列答案
相关题目
下列过程属于氮的固定的是( )
| A、氮气和氢气合成氨气 |
| B、氨气和硝酸合成硝酸铵 |
| C、二氧化氮制备硝酸 |
| D、从空气中分离出氮气 |
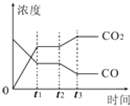 Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g) 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.