题目内容
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
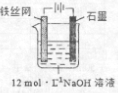
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4 mol?L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为
考点:铁盐和亚铁盐的相互转变,氧化还原反应,化学电源新型电池,难溶电解质的溶解平衡及沉淀转化的本质
专题:电化学专题,元素及其化合物
分析:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;依高铁酸根离子水解平衡移动的影响因素解答;
(2)①Fe2O3、KNO3、KOH混合加热发生氧化还原反应,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低到+3价,依据氧化还原反应得失电子守恒规律计算;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数,根据电荷守恒确定OH-系数,根据氢元素守恒确定H2O系数,检查氧元素守恒,据此写出氧化还原反应方程式;
③电解时阳极Fe失电子发生氧化反应,被氧化生成高铁酸根离子;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,锌化合价升高,发生氧化反应,做负极,高铁酸根离子在正极得到电子,发生还原反应生成氢氧化铁;
(4)依据溶度积规则,当Qc=Ksp达到沉淀溶解平衡,要产生沉淀则Qc>Ksp,据此解答.
(2)①Fe2O3、KNO3、KOH混合加热发生氧化还原反应,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低到+3价,依据氧化还原反应得失电子守恒规律计算;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数,根据电荷守恒确定OH-系数,根据氢元素守恒确定H2O系数,检查氧元素守恒,据此写出氧化还原反应方程式;
③电解时阳极Fe失电子发生氧化反应,被氧化生成高铁酸根离子;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
(4)依据溶度积规则,当Qc=Ksp达到沉淀溶解平衡,要产生沉淀则Qc>Ksp,据此解答.
解答:
解:(1)K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质;4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑,增大溶液中的氢氧根离子浓度,能够使平衡逆向移动,抑制高铁酸根离子的水解,所以同浓度的高铁酸钾在pH为11.50的水溶液中最稳定;
故答案为:杀菌消毒、吸附悬浮物;11.50;
(2)①Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,Fe2O3做还原剂;N元素化合价由+5价降低到+3价,
KNO3做氧化剂,设氧化剂物质的量为xmol,还原剂物质的量为ymol,要使氧化剂得到电子总数等于还原剂失去电子总数,x×(5-3)=y×2×(6-3),解得x:y=3:1;
故答案为:3:1;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数为3,根据电荷守恒确定OH-系数8,根据氢元素守恒确定H2O系数为4,反应离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,锌化合价升高,发生氧化反应,做负极,高铁酸根离子在正极得到电子,发生还原反应生成氢氧化铁,电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
故答案为:Zn;FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
(4)解:设加入Ca(OH)2的物质的量为xmol,则溶液中钙离子浓度为x×10-3mol/L,含有2.0×l0-4 mol?L-lK2FeO4的废水中的c(FeO42-)=2.0×l0-4 mol?L-l,
Qc=x×10-3mol/L×2.0×l0-4 mol?L-l=Ksp=4.54×l0-9;
解得:x=2.27×10-2;
故答案为:2.27×10-2.
故答案为:杀菌消毒、吸附悬浮物;11.50;
(2)①Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,Fe2O3做还原剂;N元素化合价由+5价降低到+3价,
KNO3做氧化剂,设氧化剂物质的量为xmol,还原剂物质的量为ymol,要使氧化剂得到电子总数等于还原剂失去电子总数,x×(5-3)=y×2×(6-3),解得x:y=3:1;
故答案为:3:1;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数为3,根据电荷守恒确定OH-系数8,根据氢元素守恒确定H2O系数为4,反应离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
故答案为:Zn;FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
(4)解:设加入Ca(OH)2的物质的量为xmol,则溶液中钙离子浓度为x×10-3mol/L,含有2.0×l0-4 mol?L-lK2FeO4的废水中的c(FeO42-)=2.0×l0-4 mol?L-l,
Qc=x×10-3mol/L×2.0×l0-4 mol?L-l=Ksp=4.54×l0-9;
解得:x=2.27×10-2;
故答案为:2.27×10-2.
点评:本题为综合题,考查了氧化还原反应方程式的书写及配平、电极反应式的书写、溶度积规则的应用,题目难度较大,明确物质的性质及题给信息、熟悉化合物中各元素化合价、沉淀溶解平衡规律是解本题关键,氧化还原方程式的书写是难点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
铊(元素符号Tl)是超导材料组成元素之一,位于第六周期,与元素Al同主族.以下对于铊(Tl)的性质推断错误的是( )
| A、Tl是易导电的银白色的金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、Tl的还原性强于Al |
| D、Tl能生成+3价的化合物 |
下列有关物质应用的说法中不正确的是( )
| A、碳酸钠用于治疗胃溃疡病人的胃酸过多症 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、明矾用于净化生活用水 |
| D、Fe2O3用于制作红色染料 |
3月28日,中国广东核电集团韶关核电筹建处在韶关揭牌.韶关核电项目是广东省2009年的重点预备项目,它的建设对于粤北山区和韶关经济社会的可持续发展具有重要的意义.铀-235(
U)能直接用作核电站的“燃料”,下列关于铀-235的说法正确的是( )
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
| D、铀元素的相对原子质量为235 |

 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.