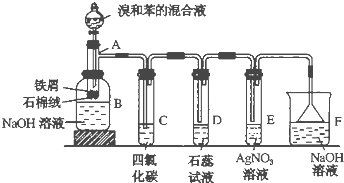
题目内容
在50mL a mol?L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)=3mol?L-1.
(1)求稀释后的溶液的pH= .
(2)若生成的气体中NO2的物质的量为0.125mol,则a= .
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述(2)中的NO2和NO的混合气体通入2mol?L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL.生成的NaNO2为 mol.
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2
4N2+6H2O 6NO2+8NH3
7N2+12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为 (精确到0.01).
②要处理5m3的尾气,需要氨氧混合气的体积为 L.
(1)求稀释后的溶液的pH=
(2)若生成的气体中NO2的物质的量为0.125mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述(2)中的NO2和NO的混合气体通入2mol?L-1的NaOH恰好被吸收,求NaOH溶液的体积为
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为
②要处理5m3的尾气,需要氨氧混合气的体积为
考点:化学方程式的有关计算
专题:计算题
分析:(1)溶液c(Cu2+)=n(Cu),由电荷守恒可知溶液中c(NO3-)=c(H+)+2c(Cu2+),据此计算c(H+),代入PH=-lgc(H+)计算;
(2)根据电子转移守恒计算NO的物质的量,再根据N元素守恒计算n(HNO3),进而计算原硝酸溶液浓度;
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO),根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3),再根据V=
计算溶液体积;
根据方程式计算生成NaNO2的物质的量;
(4)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,根据尾气中氮氧化合物的含量列方程计算x的值,再根据方程式计算需要NH3、O2的物质的量,根据M=
计算其平均相对分子质量;
②结合①中的数据,根据V=nVm计算处理1m3尾气需要氨氧混合物的体积,进而计算处理5m3的尾气需要氨氧混合气的体积.
(2)根据电子转移守恒计算NO的物质的量,再根据N元素守恒计算n(HNO3),进而计算原硝酸溶液浓度;
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO),根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3),再根据V=
| n |
| c |
根据方程式计算生成NaNO2的物质的量;
(4)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,根据尾气中氮氧化合物的含量列方程计算x的值,再根据方程式计算需要NH3、O2的物质的量,根据M=
| m |
| n |
②结合①中的数据,根据V=nVm计算处理1m3尾气需要氨氧混合物的体积,进而计算处理5m3的尾气需要氨氧混合气的体积.
解答:
解:(1)6.4g Cu的物质的量为
=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,溶液中c(NO3-)=c(H+)+2c(Cu2+),所以溶液中c(H+)=c(NO3-)-2c(Cu2+)=3mol/L-
×2=1mol/L,所以pH=-lg1=0,
故答案为:0;
(2)根据电子转移守恒,NO的物质的量=
=0.025mol,根据N元素守恒,原溶液中n(HNO3)=0.125mol+0.025mol+0.1L×3mol/L=0.45mol,故原硝酸的浓度为
=9mol/L,
故答案为:9;
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.125mol+0.025mol=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为
=0.075L=75mL;
NO2+NO+2NaOH=2NaNO2+H2O
0.025mol 0.025mol 0.05mol
2NO2+2NaOH=NaNO2+NaNO3+H2O
(0.125mol-0.025)mol 0.05mol
故生成NaNO2的物质的量=0.05mol+0.05mol=0.1mol,
故答案为:75;0.1;
(4)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,解得x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,
根据方程式:4NO+4NH3+O2
4N2+6H2O,可知0.06molNO需要0.06molNH3,0.015molO2,
根据方程式:6NO2+8NH3
7N2+12H2O,可知0.015molNO2需要0.02molNH3,所以氨氧混合气体的平均摩尔质量=
=19.37g/mol,所以其相对分子质量为19.37,
故答案为:19.37;
②处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,
故答案为:10.64.
| 6.4g |
| 64g/mol |
| 0.1mol |
| 0.1L |
故答案为:0;
(2)根据电子转移守恒,NO的物质的量=
| 0.1mol×2-0.125mol×1 |
| 3 |
| 0.45mol |
| 0.05L |
故答案为:9;
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.125mol+0.025mol=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为
| 0.15mol |
| 2mol/L |
NO2+NO+2NaOH=2NaNO2+H2O
0.025mol 0.025mol 0.05mol
2NO2+2NaOH=NaNO2+NaNO3+H2O
(0.125mol-0.025)mol 0.05mol
故生成NaNO2的物质的量=0.05mol+0.05mol=0.1mol,
故答案为:75;0.1;
(4)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,解得x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,
根据方程式:4NO+4NH3+O2
| 催化剂 |
| 140℃ |
根据方程式:6NO2+8NH3
| 催化剂 |
| 140℃ |
| (0.06+0.02)mol×17g/mol+0.015mol×32g/mol |
| 0.06mol+0.02mol+0.015mol |
故答案为:19.37;
②处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,
故答案为:10.64.
点评:本题考查含氮物质的有关计算,侧重考查学生的分析计算能力,题目计算量较大,为易错题目,注意利用守恒法,结合方程式来分析解答,难度较大.

练习册系列答案
相关题目
某溶液用石蕊试液试验显红色,用甲基橙试液显黄色,则该溶液的pH值( )
| A、PH<5 |
| B、4.4<PH<5 |
| C、PH>8 |
| D、3.1<PH<4.4 |
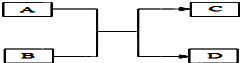 A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.
A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.

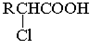 ;RCH2Br
;RCH2Br 研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.