题目内容
 研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.(1)二氧化碳合成甲醇是碳减排的新方向,
已知:
①2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1
②CH3OH(g)+
| 3 |
| 2 |
| n(CH3OH) |
| n(CO2) |
(2)工业上以CO和H2为原料合成甲醇化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H
①在容积为1L的密闭容器中充入1molCO,实验测得平衡时甲醇的物质的量和温度的关系如下表,则该正反应的△H
| 温 度 | 300℃ | 400℃ | 500℃ |
| n(甲醇)/mol | 0.21 | 0.17 | 0.11 |
| n(H2) |
| n(CO) |
(3)甲醇燃料电池在碱性介质中工作时的正极电极反应式为:
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,化学平衡的影响因素,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(2)①根据图中数据结合温度对平衡的影响分析平衡时甲醇的物质的量和温度的关系;
②正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;
(3)原电池放电时,阴离子向负极移动,负极上失电子发生氧化反应,正极上得电子发生还原反应,碱性燃料电池中氧气在正极得电子生成氢氧根离子,根据甲醇和转移电子之间的关系式计算.
(2)①根据图中数据结合温度对平衡的影响分析平衡时甲醇的物质的量和温度的关系;
②正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;
(3)原电池放电时,阴离子向负极移动,负极上失电子发生氧化反应,正极上得电子发生还原反应,碱性燃料电池中氧气在正极得电子生成氢氧根离子,根据甲醇和转移电子之间的关系式计算.
解答:
解:(1)①2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1
②CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=-677kJ?mol-1;依据盖斯定律①×
-②得到CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ?mol-1;为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,可通过增大压强或者降低温度等实现,或增加甲醇的物质的量,反应虽然向逆反应方向移动,但反应的比增加的少,二者比值增大,
故答案为:CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ?mol-1;增大压强或者降低温度等或增加甲醇的物质的量;
(2)①根据实验测得平衡时甲醇的物质的量和温度的关系,n(甲醇)/mol,300℃,0.21,400℃,0.17,说明温度越高,甲醇的物质的量越少,平衡向逆反应方向移动,即逆反应方向为吸热方向,所以正反应方向为放热方向,即△H<0,
故答案为:<;
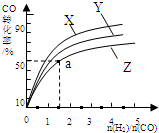
根据该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
=
=4,
故答案为:270℃;4;
(3)燃料电池的负极上是燃料甲醇发生失电子的氧化反应,电解质环境是碱性,正极上氧气在正极得电子生成氢氧根离子,反应为:O2+2H2O+4e-=4OH-,
当6.4g甲醇完全反应时,电子转移个数=
×6momol=1.2mol,
故答案为:O2+2H2O+4e-=4OH-;1.2.
②CH3OH(g)+
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ?mol-1;增大压强或者降低温度等或增加甲醇的物质的量;
(2)①根据实验测得平衡时甲醇的物质的量和温度的关系,n(甲醇)/mol,300℃,0.21,400℃,0.17,说明温度越高,甲醇的物质的量越少,平衡向逆反应方向移动,即逆反应方向为吸热方向,所以正反应方向为放热方向,即△H<0,
故答案为:<;
根据该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.5×0.5 |
故答案为:270℃;4;
(3)燃料电池的负极上是燃料甲醇发生失电子的氧化反应,电解质环境是碱性,正极上氧气在正极得电子生成氢氧根离子,反应为:O2+2H2O+4e-=4OH-,
当6.4g甲醇完全反应时,电子转移个数=
| 6.4g |
| 32g/mol |
故答案为:O2+2H2O+4e-=4OH-;1.2.
点评:本题考查了利用盖斯定律书写热化学反应方程式、电极反应式的书写和平衡等知识点,平衡移动是学习难点,为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量,或增加甲醇的物质的量为解答易漏答的要点,题目难度中等.

练习册系列答案
相关题目
 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题: ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: