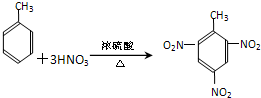
题目内容
质量相同的Na、Mg、Al、Zn分别放入足量的稀盐酸中,在相同的条件下,产生氢气最多的是( )
| A.Na | B.Mg | C.Al | D.Zn |
令金属的质量为1g,则:
2Na+2HCl=2NaCl+H2↑
46 2
1g a
a=
=
g
Mg+2HCl=MgCl2+H2↑
24 2
1g b
b=
=
g
2Al+6HCl=AlCl3+3H2↑
54 6
1g c
c=
=
g
Zn+2HCl=ZnCl2+H2↑
65 2
1g d
d=
=
g
故生成氢气的质量:Al>Mg>Na>Zn,
故选C.
2Na+2HCl=2NaCl+H2↑
46 2
1g a
a=
| 1g×2 |
| 46 |
| 1 |
| 23 |
Mg+2HCl=MgCl2+H2↑
24 2
1g b
b=
| 1g×2 |
| 24 |
| 1 |
| 12 |
2Al+6HCl=AlCl3+3H2↑
54 6
1g c
c=
| 1g×6 |
| 54 |
| 1 |
| 9 |
Zn+2HCl=ZnCl2+H2↑
65 2
1g d
d=
| 1g×2 |
| 65 |
| 1 |
| 32.5 |
故生成氢气的质量:Al>Mg>Na>Zn,
故选C.

练习册系列答案
相关题目