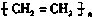题目内容
已知随着硝酸浓度的不同,Fe与硝酸反应会生成NO或NO2;Fe3+能与Fe发生下列反应:2Fe3++Fe═3Fe2+.现将某铁块与50g溶质的质量分数为63%的硝酸溶液发生反应,若反应中生成的气体均完全逸出并全部收集,请通过计算回答下列问题:
(1)若反应后,铁块全部溶解,硝酸仍有剩余,只收集到NO2气体,其体积在标准状况下为3.36L,则参加反应的Fe质量为______g.
(2)若反应后,硝酸完全消耗,铁块仍有剩余,收集到的气体是NO2和NO的混合气体,其体积在标准状况下也为3.36L,则参加反应的Fe质量为______g.
(3)若该铁块是表面含有Fe2O3的铁块,质量为15g,且该铁块与上述硝酸恰好完全反应.如果将铁块中单质Fe的质量分数设为ω,则ω理论上的最大值是:______.
(1)若反应后,铁块全部溶解,硝酸仍有剩余,只收集到NO2气体,其体积在标准状况下为3.36L,则参加反应的Fe质量为______g.
(2)若反应后,硝酸完全消耗,铁块仍有剩余,收集到的气体是NO2和NO的混合气体,其体积在标准状况下也为3.36L,则参加反应的Fe质量为______g.
(3)若该铁块是表面含有Fe2O3的铁块,质量为15g,且该铁块与上述硝酸恰好完全反应.如果将铁块中单质Fe的质量分数设为ω,则ω理论上的最大值是:______.
(1)反应后,铁块全部溶解,硝酸仍有剩余,Fe被氧化生成Fe(NO3)3,
生成NO2的物质的量为
=0.15mol,
根据电子转移守恒,可知n(Fe)=
=0.05mol,
故铁的质量为0.05mol×56g/mol=2.8g,
故答案为:2.8;
(2)若反应后,硝酸完全消耗,铁块仍有剩余,Fe被氧化生成Fe(NO3)2,
NO、NO2的总物质的量为
=0.15mol,
根据氮元素守恒,起酸的作用的硝酸的物质的量为:
-0.15mol=0.35mol,
故参加反应的n(Fe)=0.35mol×
=0.175mol,
参加反应的铁的质量0.175mol×56g/mol=9.8g,
故答案为:9.8;
(3)若该铁块是表面含有Fe2O3的铁块,与上述硝酸恰好完全反应,当反应生成Fe(NO3)2与NO时,铁块中Fe的质量最大,其质量分数最大,发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O、Fe2O3+Fe+6HNO3═3Fe(NO3)2+3H2O,
硝酸的物质的量为:
=0.5mol,
令铁块中Fe、Fe2O3的物质的量分别为xmol、ymol,则:
3Fe+8HNO3 ═3Fe(NO3)2 +2NO↑+4H2O、
(x-y)
(x-y)
Fe2O3+Fe+6HNO3═3Fe(NO3)2+3H2O,
y y 6y
所以,
解得,x=0.125、y=0.05,
故单质铁的质量分数ω理论上的最大值是
×100%=46.7%,
故答案为:46.7%.
生成NO2的物质的量为
| 3.36L |
| 22.4L/mol |
根据电子转移守恒,可知n(Fe)=
| 0.15mol×(5-4) |
| 3 |
故铁的质量为0.05mol×56g/mol=2.8g,
故答案为:2.8;
(2)若反应后,硝酸完全消耗,铁块仍有剩余,Fe被氧化生成Fe(NO3)2,
NO、NO2的总物质的量为
| 3.36L |
| 22.4L/mol |
根据氮元素守恒,起酸的作用的硝酸的物质的量为:
| 50g×63% |
| 63g/mol |
故参加反应的n(Fe)=0.35mol×
| 1 |
| 2 |
参加反应的铁的质量0.175mol×56g/mol=9.8g,
故答案为:9.8;
(3)若该铁块是表面含有Fe2O3的铁块,与上述硝酸恰好完全反应,当反应生成Fe(NO3)2与NO时,铁块中Fe的质量最大,其质量分数最大,发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O、Fe2O3+Fe+6HNO3═3Fe(NO3)2+3H2O,
硝酸的物质的量为:
| 50g×63% |
| 63g/mol |
令铁块中Fe、Fe2O3的物质的量分别为xmol、ymol,则:
3Fe+8HNO3 ═3Fe(NO3)2 +2NO↑+4H2O、
(x-y)
| 8 |
| 3 |
Fe2O3+Fe+6HNO3═3Fe(NO3)2+3H2O,
y y 6y
所以,
|
解得,x=0.125、y=0.05,
故单质铁的质量分数ω理论上的最大值是
| 0.125mol×56g/mol |
| 15g |
故答案为:46.7%.

练习册系列答案
相关题目
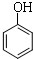 +3Br2→2
+3Br2→2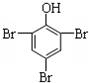 ↓
↓