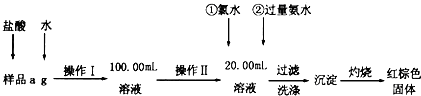
题目内容
元素周期表是学习化学的重要工具,它隐含许多信息和规律,以下为周期表中1~18号元素

(1)a、b、f三元素原子半径大小关系为 > > (填元素符号,下同)
(2)c、d、e三元素最高正化合价大小关系为 > >
(3)元素h与i氢化物的稳定性强弱为 > (填化学式)
(4)写出f最高价氧化物水化物溶液和g最高价氧化物水化物反应的离子方程式: .
(5)用电子式表示f和i单质形成化合物的过程: .

(1)a、b、f三元素原子半径大小关系为
(2)c、d、e三元素最高正化合价大小关系为
(3)元素h与i氢化物的稳定性强弱为
(4)写出f最高价氧化物水化物溶液和g最高价氧化物水化物反应的离子方程式:
(5)用电子式表示f和i单质形成化合物的过程:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素所在周期表中的位置可知:a为氢,b为锂,c为碳,d为氮,e为氧,f为钠,g为铝,h为硫,i为氯,
(1)同一主族,随着原子序数的增大,原子半径增大;
(2)元素的最高最高正价=其所在族序数,考虑特殊情况,O无正价;
(3)元素的非金属性越强,其氢化物越稳定;
(4)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,据此书写离子反应方程式;
(5)NaCl为离子化合物,即钠离子与氯离子形成的化合物,据此书写形成过程即可.
(1)同一主族,随着原子序数的增大,原子半径增大;
(2)元素的最高最高正价=其所在族序数,考虑特殊情况,O无正价;
(3)元素的非金属性越强,其氢化物越稳定;
(4)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,据此书写离子反应方程式;
(5)NaCl为离子化合物,即钠离子与氯离子形成的化合物,据此书写形成过程即可.
解答:
解:依据分析可知:a为氢,b为锂,c为碳,d为氮,e为氧,f为钠,g为铝,h为硫,i为氯,
(1)同一主族,随着原子序数的增大,原子半径增大,由于原子序数Na>Li>H,故答案为:Na、Li、H;
(2)元素的最高最高正价=其所在族序数,考虑特殊情况,O无正价,故答案为:N;C;O;
(3)元素的非金属性越强,其氢化物越稳定,由于非金属性Cl>S,故答案为:HCl;H2S;
(4)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,离子反应方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(5)NaCl为离子化合物,即钠离子与氯离子形成的化合物,形成过程为: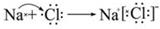 ,故答案为:
,故答案为: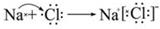 .
.
(1)同一主族,随着原子序数的增大,原子半径增大,由于原子序数Na>Li>H,故答案为:Na、Li、H;
(2)元素的最高最高正价=其所在族序数,考虑特殊情况,O无正价,故答案为:N;C;O;
(3)元素的非金属性越强,其氢化物越稳定,由于非金属性Cl>S,故答案为:HCl;H2S;
(4)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,离子反应方程式为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(5)NaCl为离子化合物,即钠离子与氯离子形成的化合物,形成过程为:
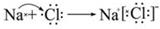 ,故答案为:
,故答案为: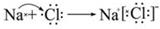 .
.
点评:本题考查元素在周期表中的位置及元素的性质,利用周期表推出元素是解答的关键,并熟悉物质的性质即可解答,难度不大.

练习册系列答案
相关题目
下列关于物质性质的描述错误的是( )
| A、硝酸是易挥发的强酸 |
| B、纯碱溶液能使酚酞溶液品红色 |
| C、CO是无色难溶于水的气体 |
| D、Fe3+可以与KSCN溶液反应生成血红色沉淀 |
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量为△H1;等量的氢气在同样条件下完全燃烧生成液态水,放出热量为△H2;△H1与△H2的关系为( )
| A、△H1<△H2 |
| B、△H1=△H2 |
| C、△H1>△H2 |
| D、无法确定 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池.电池的总反应为:CH4+2O2+2KOH=K2CO3+3H2O则下列说法正确的是( )
①通入甲烷的电极为电池的正极,
②通入氧气的电极为正极
③每有1molCH4被氧化,转移8mol电子
④电池放电后,溶液PH不断升高.
①通入甲烷的电极为电池的正极,
②通入氧气的电极为正极
③每有1molCH4被氧化,转移8mol电子
④电池放电后,溶液PH不断升高.
| A、①② | B、②③ | C、①④ | D、③④ |
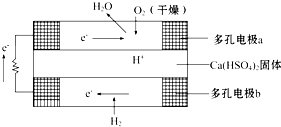 如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )| A、H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B、a极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D、H+由b极通过固体酸电解质传递到a极 |
己知向NaNO2溶液中加入酸性KMn04溶液发生如下反应:2KMn04+5NaNO2+3H2S04=2MnSO4+5NaNO3+K2SO4+3H2O 有关该反应的下列说法中正确的是( )
| A、KMn04作氧化剂 |
| B、该反应不属于离子反应 |
| C、氮元素被还原 |
| D、当反应中转移10 mol电子时,生成lmol MnS04 |
下列解释实验现象的离子反应方程式正确的是( )
A、硫酸铵溶液显酸性:NH
| ||
| B、向AgCl悬浊液中加Na2S溶液,白色沉淀变成黑色:2Ag++S2-=Ag2S↓ | ||
| C、将足量CO2通入Na2SiO3溶液中,出现白色沉淀:SiO32-+CO2+H2O=H2SiO3↓+CO32- | ||
| D、向NaAlO2溶液中加入NaHCO3溶液,出现白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑ |