题目内容
10.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: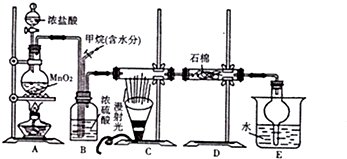
根据要求填空:
(1)制取Cl2时的操作依次是dcab(填标号).
a.往烧瓶中加入浓盐酸 b.加热 c.往烧瓶中加入MnO2粉末 d.检查装置气密性
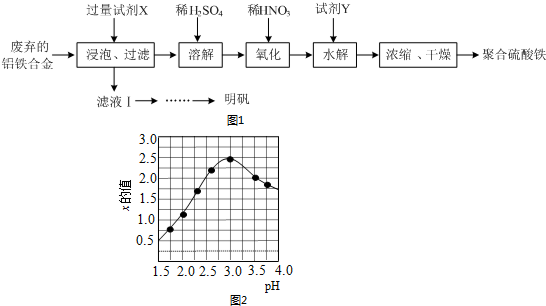
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的HCl,则x值应≥4.
(3)B装置有三种作用:①均匀混合气体;②干燥气体;③控制气体流速.
(4)在C装置中,经过一段时间的光照,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式CH4+2Cl2$\stackrel{光照}{→}$C+4HCl.D装置中的石棉中均匀混有KI粉末,其作用是能吸收过量的氯气.E装置中除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法是分液(填分离方法名称),实验用到的玻璃仪器有分液漏斗、烧杯(填仪器名称).
(5)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为ab(填编号).
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4.
分析 (1)先检验装置气密性,再加入二氧化锰,然后加入浓盐酸,最后加热制备氯气;
(2)甲烷完全取代生成CCl4时获得的HCl最多;
(3)B装置进行气体干燥,并均匀混合气体,根据气泡可以控制气体流量;
(4)生成的黑色小颗粒为炭黑,光照条件下甲烷和氯气反应生成碳和氯化氢;
碘化钾能与剩余的氯气反应;
最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;
(5)一氯甲烷是气体,还可能有过量的甲烷.
解答 解:(1)先检验装置气密性,再加入二氧化锰,然后加入浓盐酸,最后加热制备氯气,制取Cl2时的操作依次是dcab,
故答案为:dcab;
(2)甲烷完全取代生成CCl4时获得的HCl最多,由CH4+4Cl2$\stackrel{光}{→}$CCl4+4HCl,可知$\frac{V(C{l}_{2})}{V(C{H}_{4})}$≥4,
故答案为:≥4;
(3)因浓硫酸具有吸水性,可以干燥气体,并均匀混合气体,根据气泡可以控制气体流速,
故答案为:干燥气体;控制气体流速;
(4)生成的黑色小颗粒为炭黑,光照条件下甲烷和氯气反应生成碳和氯化氢,反应方程式为:CH4+2Cl2$\stackrel{光照}{→}$C+4HCl,
碘化钾能与剩余的氯气反应,吸收过量的氯气;
E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液方法分离,用到的玻璃仪器有分液漏斗、烧杯,
故答案为:CH4+2Cl2$\stackrel{光照}{→}$C+4HCl;吸收过量的氯气;分液;分液漏斗、烧杯;
(5)反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,
故选:ab.
点评 本题考查了化学实验,涉及氯气的制备、物质的分离提纯、甲烷与氯气的取代反应等,侧重对装置与原理的考查,掌握常见物质分离提纯方法,注意渗透环保意识.

| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 质谱 | D. | 银镜反应 |
| A. | 煤经过分馏可得到焦炭、煤焦油和焦炉气 | |
| B. | 石油裂化是为了获得更多的汽油 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 甲烷、汽油、酒精都是可燃性烃,都可作燃料 |
| A. | CH≡CH+2Br2→CHBr2-CHBr2 | B. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | ||
| C. |  +HCN$\stackrel{催化剂}{→}$ +HCN$\stackrel{催化剂}{→}$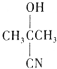 | D. | CH3COOH+NH3$\stackrel{△}{→}$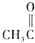 -NH2+H20 -NH2+H20 |
| A. | 某些强氧化剂(如氯酸钾、高锰酸钾等)或其混合物不能研磨,否则易引起爆炸 | |
| B. | 达到滴定终点后,静置1~2min再读数,主要是为了防止管壁有液体残留引起误差 | |
| C. | 在用简易量热计测定反应热时,一般采取下列实验措施:使用碎泡沫起隔热保温、用普通玻璃棒进行搅拌,准确读取反应前后温度、取2~3次的实验平均值 | |
| D. | 某溶液可能含有SO42-和Cl-,可先加足量的硝酸钡,取上层清液再加稀硝酸和硝酸银,来检验其中的Cl- |
| A. | 均为ⅠA族元素,最外层均有1个电子 | |
| B. | 单质的还原性:Li>Na>K>Rb>Cs | |
| C. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| D. | 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大 |
| A. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 0.1mol•L-1Na2CO3与0.05mol•L-1NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |