题目内容
1.将57.6克的铜投入200毫升的硝酸溶液中恰好反应完全,产生标准状况下的NO2、NO共1.4mol.(1)写出刚开始反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)求硝酸的浓度1.6mol•L-1
(3)将生成的气体收集在大试管中,然后倒扣在水中,写出二氧化氮与水反应的化学方程式3NO2+H2O═2HNO3+NO,若反应完全,则最后试管中NO的物质的量0.6mol.若往试管中通入氧气让液体充满试管问通入氧气的物质的量0.45mol.
分析 (1)Cu和浓硝酸反应生成硝酸铜、二氧化氮和水,和稀硝酸反应生成硝酸铜、NO和水;
(2)n(Cu)=$\frac{57.6g}{64g/mol}$=0.9mol,Cu和硝酸恰好完全反应生成NO2、NO,生成物还有Cu(NO3)2,根据N原子守恒计算硝酸的物质的量,再根据c=$\frac{n}{V}$计算硝酸物质的量浓度;
(3)二氧化氮和水反应生成硝酸和NO,则相当于原来的硝酸和Cu反应生成NO和硝酸铜,根据转移电子守恒计算NO物质的量;通入氧气后,氧气和NO反应生成二氧化氮、二氧化氮和水反应生成硝酸和NO,所以得到二氧化氮、水和氧气反应生成硝酸,根据转移电子守恒计算消耗氧气的物质的量.
解答 解:(1)Cu和浓硝酸反应生成硝酸铜、二氧化氮和水,和稀硝酸反应生成硝酸铜、NO和水,开始时硝酸浓度较大,所以生成二氧化氮,则开始时反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)n(Cu)=$\frac{57.6g}{64g/mol}$=0.9mol,Cu和硝酸恰好完全反应生成NO2、NO,生成物还有Cu(NO3)2,根据N原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.9mol+1.4mol=3.2mol,c(HNO3)=$\frac{n}{V}$=$\frac{0.32mol}{0.2L}$=1.6mol/L,
故答案为:1.6;
(3)二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O═2HNO3+NO,则相当于原来的硝酸和Cu反应生成NO和硝酸铜,根据转移电子守恒计算n(NO)=$\frac{0.9mol×2}{3}$=0.6mol;通入氧气后,氧气和NO反应生成二氧化氮、二氧化氮和水反应生成硝酸和NO,所以得到二氧化氮、水和氧气反应生成硝酸,根据转移电子守恒计算消耗n(O2)=$\frac{0.6mol×3}{4}$=0.45mol,
故答案为:3NO2+H2O═2HNO3+NO;0.6;0.45.
点评 本题以Cu和硝酸反应为载体考查氧化还原反应有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意原子守恒、转移电子守恒的灵活运用,易错点是(3)NO的物质的量计算.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案| A. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4; 途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | 78gNa2O2中存在的共价键总数为NA(NA为阿伏伽德罗常数的值) | |
| D. | 18gD2O中含有的质子数为10NA(NA为阿伏伽德罗常数的值) |
 的命名正确的是( )
的命名正确的是( )| A. | 2,4,4-三甲基戊烷 | B. | 2,4-二甲基戊烷 | ||
| C. | 2,2,4-三甲基戊烷 | D. | 4,4-二甲基己烷 |
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在二氧化硅晶体中,围成最小环的原子数 | |
| C. | 在金刚石晶体中,围成最小环的原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cs+的个数 |

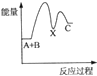
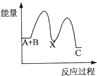
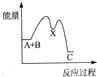
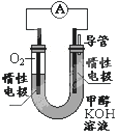 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.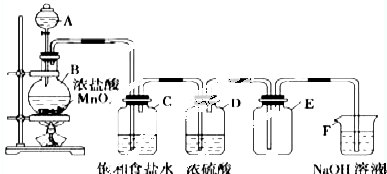
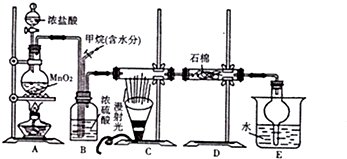

 .
.