题目内容
13.在生产和生活上应用的含氯消毒剂、漂白剂有多种,如HClO、NaClO、ClO2等.(1)氯气是合成含氯消毒剂的原料.在催化剂、420℃的条件下,氧气与氯化氢气体反应可置换出氯气,利用表数据写出该反应的热化学方程式O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol.
| 化学键 | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ.mol-1) | 247 | 498 | 463 | 431 |
A.向氯水中加入少量Na2CO3粉末,其漂白性增强
B.向氯水中通人氯气,c(H+)/c(ClO-)减小
C.加水稀释氯水,溶液中的所有离子浓度均减小
D.加水稀释氯水,水的电离平衡向正反应方向移动
(3)漂白液的有效成分是NaClO,研究漂白液的稳定性对
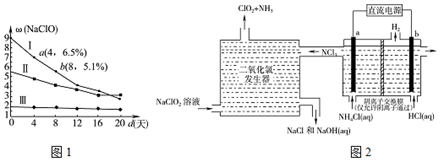
其生产和保存有实际意义.图1是30℃时,三种漂白液中NaClO的质量分数随时间的变化关系.
①分解速率v(I)>v(Ⅱ)(填“>”“<”或“=”)
②漂白液I在4~8天内的分解速率为3.5g'L-l.d-1.(常温下漂白液的密度近似等于1g•cm-3,溶液体积变化忽略不计)
(4)ClO2是一种安全稳定的消毒剂.工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2,原理如图2:
①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为
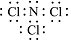 .
.②电解池中总反应的离子方程式为NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则理论上b电极上产生氢气的质量为
0.6g.
分析 (1)反应的化学方程式为O2(g)+4HCl(g)=2Cl2(g)+2H2O(g),△H=反应物键能和-生成物键能和;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
A.在下列平衡:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应平衡正向进行;
B.向氯水中通人氯气,平衡正向进行,溶液中氢离子浓度增大;
C.溶液中存在离子积常数,加水稀释氢离子浓度减小,氢氧根离子浓度增大;
D.加水稀释氯水,溶液中氢离子浓度减小,水的抑制程度减小;
(3)①一般来说浓度越大,反应速率越大;
②4d~8d,NaClO的含量由6.5%变为5.1%,假设溶液体积为1L,计算NaClO的消耗的量,进而计算速率;
(4)①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体是氮原子和三个氯原子形成三对共用电子对形成的共价化合物;
②电解池中总反应是惰性电极电解氯化铵和盐酸生成氢气和NCl3气体;
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,物质的量n(NH3)=$\frac{2.24L}{22.4L/mol}$=0.1mol,结合化学方程式电子守恒计算b电极上产生氢气的质量;
解答 解:(1))上述反应的化学方程式为O2(g)+4HCl(g)=2Cl2(g)+2H2O(g),△H=反应物键能和-生成物键能和=498KJ/mol+4×431KJ/mol-2×247KL/mol-4×463KJ/mol=-133KJ/mol,所以,其热化学方程式为O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol,
故答案为:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol;
(2)氯气溶于水,发生Cl2+H2O═H++Cl-+HC1O,则该反应的平衡常数表达式K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$,
A.向氯水中加入少量Na2CO3粉末,和溶液中盐酸反应,平衡正向进行,次氯酸浓度增大其漂白性增强,故A正确;
B.向氯水中通人氯气,平衡正向进行,溶液中氢离子浓度增大,c(H+)/c(ClO-)增大,故B错误;
C.加水稀释氯水,溶液中平衡状态下的所有离子浓度均减小,溶液中存在离子积常数,氢氧根离子浓度增大,故C错误;
D.加水稀释氯水,溶液中氢离子浓度减小,水的电离平衡向正反应方向移动,故D正确;
故答案为:$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$;AD;
(3)①图2为NaClO的质量百分含量,在相同时间内,NaClO的质量百分含量改变越大,则v(Ⅰ)>v(Ⅱ),v(Ⅰ)时NaClO的浓度大于v(Ⅱ)时NaClO的浓度,在相同的条件下,NaClO的浓度越大分解速率越大.
故答案为:>;
②4d~8d,NaClO的含量由6.5%变为5.1%,假设溶液体积为1L,v(NaClO)=[(6.5%-5.1%)×1g/mL×103÷74.5g/mol]÷4d=0.047mol/(L.d)=0.047mol/(L.d)×74.5g/mol=3.5g'L-l.d-1,
故答案为:3.5;
(4)①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体是氮原子和三个氯原子形成三对共用电子对形成的共价化合物,电子式为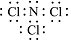 ,
,
故答案为: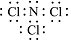 ;
;
②电解池中总反应是惰性电极电解氯化铵和盐酸生成氢气和NCl3,反应的离子方程式为:NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,NCl3和次氯酸钠溶液反应生成NH3、ClO2、NaCl、NaOH,
故答案为:NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,物质的量n(NH3)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则n(NCl3)=0.1mol,结合元素守恒计算,NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,生成氢气物质的量0.3mol,b电极上产生氢气的质量=0.3mol×2g/mol=0.6g,
故答案为:0.6.
点评 本题考查了化学反应的能量变化、化学平衡影响因素的分析判断、电解原理分析和计算,元素守恒的计算,图象的综合应用,读懂图象,计算方法的理解是解题的关键,题目难度中等.

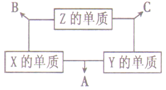 短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )| A. | Y元素位于ⅥA族 | B. | A、B、C都是非电解质 | ||
| C. | C的沸点高于B的沸点 | D. | A和C可发生氧化还原反应 |
| 难容电解质 | AgCl | AgBr | Agl | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10 -17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数可以判断相应物质的溶解性大小 | |
| B. | 将等体积的 4×10-3 mol/L 的 AgNO3 溶液和 4×10-3 mol/L K2CrO4溶液混合,有 Ag2CrO4沉淀产生 | |
| C. | 向 AgCl 的悬浊液中滴加饱和 NaBr 溶液不能得到黄色 AgBr | |
| D. | 向 100 mL 0.02mol/L 的 NaSO4 溶液中加入 100mL0.02mol/L 的 AgNO3 溶液,有白色沉淀生成 |
| A. | Z、Y、X、W的原子序数依次减小 | |
| B. | W与X可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | Z的最高价氧化物对应的水化物是短周期元素形成的最强碱 | |
| D. | X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| CH3COOH | HC1O | H2CO3 |
| Ka=1.8×l0-5 | Ka=3.0×l0-8 | Ka1=4.4×l0-7Ka2=4.7×l0-11 |
| A. | 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O═2HC1O+CO32- | |
| B. | 相同浓度的CH3COOH和NaClO的混合溶液中,水的电离程度前者大 | |
| C. | 向0.lmol•L-l的CH3COOH溶液中滴加NaOH溶液至pH=5,此时溶液的 c(CH3COOH):c(CH3COO-)=5:9 | |
| D. | 常温下,0•lmol•L-1 的 NaHC2O4 溶液 pH=4:c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
| A. |  与 与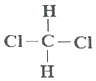 是同分异构体 是同分异构体 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| C. | 相同质量的烃完全燃烧,耗氧量最小的是CH4 | |
| D. | 乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同 |
| A. | 离子化合物中可能含有共价键 | |
| B. | 化学键是分子间强烈的作用力 | |
| C. | H、D、T表示三种氢元素 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
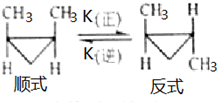 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化:
顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化: