题目内容
20.下列反应中,水作氧化剂的是( )| A. | SO3+H2O→H2SO4 | B. | 2K+2H2O→2KOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2Na2O2+2H2O→4NaOH+O2↑ |
分析 化学反应属于氧化还原反应说明该反应中有电子转移,其特征是有元素化合价变化,水作氧化剂,说明水中H元素得电子化合价降低,据此分析解答.
解答 解:属于氧化还原反应且水作氧化剂,说明该反应中有元素化合价变化且水中H元素得电子化合价降低,
A.SO3+H2O→H2SO4反应中,反应前后各元素化合价都不变,所以不是氧化还原反应,故A错误;
B.2K+2H2O→2KOH+H2↑反应水中H元素化合价由+1价变为0价,所以钾作还原剂,水作氧化剂,故B正确;
C.2F2+2H2O→4HF+O2反应中水中氧元素化合价由-2价变为0价,所以水是还原剂,故C错误;
D.该反应中过氧化钠中氧元素化合价由-1价变为-2价和-1价,水中H、O元素化合价不变,所以过氧化钠既作氧化剂又作还原剂,水既不是氧化剂也不是还原剂,故D错误;
故选B.
点评 本题考查了氧化还原反应,根据反应中元素化合价变化及氧化剂和还原剂的概念来分析解答,注意Na2O2中O元素化合价为-1价而不是-2价,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.某有机物键线式的结构为 ,关于其说法正确的是( )
,关于其说法正确的是( )
 ,关于其说法正确的是( )
,关于其说法正确的是( )| A. | 分子式为C8H10O2 | |
| B. | 可发生氧化、取代、加成反应 | |
| C. | 该有机物的含酯基的芳香族化合物的同分异构体有4种 | |
| D. | 该有机物核磁共振氢谱共有6个峰,峰面积之比为1:1:1:1:1:1 |
11.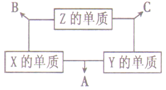 短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
 短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )| A. | Y元素位于ⅥA族 | B. | A、B、C都是非电解质 | ||
| C. | C的沸点高于B的沸点 | D. | A和C可发生氧化还原反应 |
8.短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10.下列说法不正确的是( )
| A. | 原子半径:X>Y>Z>W | B. | 单质沸点:W>Y>Z | ||
| C. | 简单氢化物的还原性:Y>Z>W | D. | W、X、Z的离子均能促进水的电离 |
15.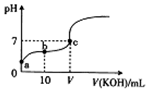 已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
 已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )| A. | a点溶液中c(H+)为4.0×10-5mol/L | |
| B. | c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-) | |
| C. | V=20 | |
| D. | a、b、c三点中水的电离程度最大的是c点 |
5.实验室用NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得高纯度的Al2O3,下列图示装置能达到实验目的是( )


| A. | 用装置甲制取NH3 | B. | 用装置乙制备Al(OH)3 | ||
| C. | 用装置丙进行过滤操作 | D. | 用装置丁灼烧Al(OH)3 |
1.已知 25℃时,几种难溶电解质的溶度积常数 Ksp 如表所示:
下列叙述正确的是( )
| 难容电解质 | AgCl | AgBr | Agl | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10 -17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数可以判断相应物质的溶解性大小 | |
| B. | 将等体积的 4×10-3 mol/L 的 AgNO3 溶液和 4×10-3 mol/L K2CrO4溶液混合,有 Ag2CrO4沉淀产生 | |
| C. | 向 AgCl 的悬浊液中滴加饱和 NaBr 溶液不能得到黄色 AgBr | |
| D. | 向 100 mL 0.02mol/L 的 NaSO4 溶液中加入 100mL0.02mol/L 的 AgNO3 溶液,有白色沉淀生成 |
2.下列说法正确的是( )
| A. |  与 与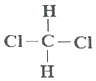 是同分异构体 是同分异构体 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| C. | 相同质量的烃完全燃烧,耗氧量最小的是CH4 | |
| D. | 乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同 |
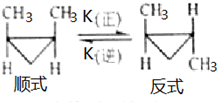 顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化:
顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化: