题目内容
1.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)?x C(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C浓度为1.2mo1•L-1(1)从开始反应至达到平衡状态,生成C的平均反应速率为0.6mol•L-1•min-1.
(2)x=3.
(3)下列各项可作为该反应达到平衡状态的标志的是BD.
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2:1 D.A的百分含量保持不变.
分析 (1)2min达到平衡,C的浓度为1.2mol/L,结合v=$\frac{△c}{△t}$计算;
(2)2min时反应达到平衡状态,此时剩余1.2mol B,计算B的反应速率,反应速率之比等于化学计量数之比;
(3)反应达到平衡状态正逆反应速率相同,各组分含量保持不变对各选项进行判断.
解答 解:(1)2min达到平衡,C的浓度为1.2mol/L,由生成C的平均反应速率为:v=$\frac{1.2mol/L}{2min}$=0.6 mol•L-1•min-1,
故答案为:0.6 mol•L-1•min-1;
(2)2min时反应达到平衡状态,此时剩余1.2mol B,则B的反应速率为:$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol•L-1•min-1,由反应速率之比等于化学计量数之比可知:x:1=0.6mol•L-1•min-1:0.2mol•L-1•min-1=,解得:x=3,
故答案为:3;
(3)2A(g)+B(g)?3C(g)+2D(s),反应前后气体体积不变,
A.反应前后 气体体积不变,反应过程中和平衡状态下压强始终不变化,压强不变不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量变化,气体物质的量不变,当气体的平均分子量不再变化,反应达到平衡状态,故B正确;
C.反应速率之比等于化学方程式系数之比,A和B的消耗速率之比为2:1,正反应方向进行,不能说明反应达到平衡状态,故C错误;
D.反应前后气体质量分数变化,气体体积不变,气体密度不再变化,说明反应达到平衡状态,故D正确;
故答案为:BD.
点评 本题考查化学平衡的计算、平衡的判定等,题目难度中等,注意利用反应速率的关系确定x为解答的关键,注重高考常考考点的考查,试题培养了学生的分析能力及灵活应用能力.

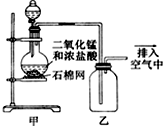
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KClO3或KMnO4 | |
| C. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 | |
| D. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
| A. | 用闻气味的方法鉴别氢气和氧气 | B. | 用氯化钡溶液鉴别盐酸和稀硫酸 | ||
| C. | 观察气体颜色区别氯气和氧气 | D. | 利用丁达尔效应区别溶液和胶体 |
| A. | PH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| A. | CH3COONH4是弱电解质 | |
| B. | 10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管终点读数时,仰视刻度线引起测量结果偏低 |
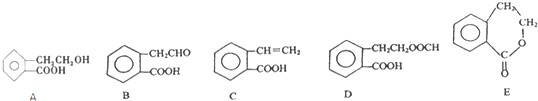
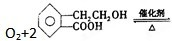 2
2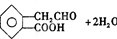
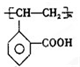
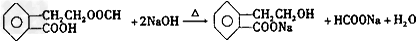 .
.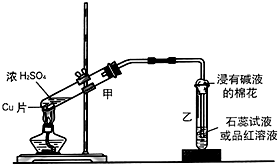 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.