题目内容
常温下,把0.1mol?L-1HA溶液(已知其pH=3)和0.05mol?L-1NaOH溶液等体积混合,混合溶液的pH=5,则下列表示混合溶液中粒子浓度关系不正确的是( )
| A、c(A-)>c(Na+) |
| B、c(HA)<c(A-) |
| C、c(Na+)>c(OH-) |
| D、c(HA)+c(A-)=0.1 mol/L |
考点:离子浓度大小的比较
专题:
分析:把0.1mol?L-1HA溶液(已知其pH=3),则酸为弱酸,和0.05mol?L-1NaOH溶液等体积混合,混合后溶质为NaA和HA,混合溶液的pH=5,根据电荷守恒和物料守恒判断.
解答:
解:A.溶液中存在电荷守恒:c(A-)+c(OH-)=c(Na+)+c(H+),pH=5显酸性,则c(H+)>c(OH-),所以c(A-)>c(Na+),故A正确;
B.混合后溶质为NaA和HA,二者物质的量相等,pH=5显酸性,则电离程度大于水解程度,所以c(HA)<c(A-),故B正确;
C.溶液显酸性,则c(OH-)很小,所以c(Na+)>c(OH-),故C正确;
D.0.1mol?L-1HA溶液(已知其pH=3)和0.05mol?L-1NaOH溶液等体积混合,体积为原来的2倍,由物料守恒可知:c(HA)+c(A-)=0.05 mol/L,故D错误.
故选D.
B.混合后溶质为NaA和HA,二者物质的量相等,pH=5显酸性,则电离程度大于水解程度,所以c(HA)<c(A-),故B正确;
C.溶液显酸性,则c(OH-)很小,所以c(Na+)>c(OH-),故C正确;
D.0.1mol?L-1HA溶液(已知其pH=3)和0.05mol?L-1NaOH溶液等体积混合,体积为原来的2倍,由物料守恒可知:c(HA)+c(A-)=0.05 mol/L,故D错误.
故选D.
点评:本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,题目难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
下列有关实验的叙述中,不合理的是( )
| A、用酸式滴定管量取25.00mL溴水 |
| B、不宜用瓷坩埚熔融氢氧化钠或碳酸钠 |
| C、测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D、圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |

 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图: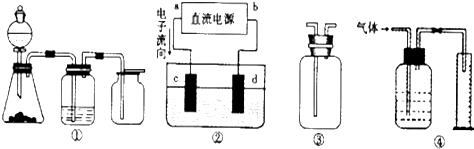
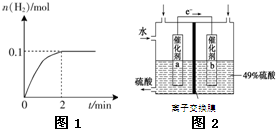 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应: