题目内容
下列混合物的除杂方法与发生反应的类型均正确的是( )
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的CuO中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和NaHCO3溶液中 | 中和反应 |
| C | 除去CaCO3中的Na2CO3 | 溶解、加入BaCl2溶液 | 复分解反应 |
| D | 除去NaCl中的Na2CO3 | 加入适量盐酸、蒸发 | 复分解反应 |
| A、A | B、B | C、C | D、D |
考点:化学基本反应类型,物质的分离、提纯和除杂
专题:
分析:根据原物质和杂质的性质选择适当的除杂试剂和分离方法,不能引入新的杂质,结合除杂时发生的反应判断反应类型.
A、氧化铜和一氧化碳反应生成铜和二氧化碳,除去了一氧化碳同时引入了二氧化碳,同时加热时有可能引起爆炸,化合反应是多变一的反应;
B、氯化氢和碳酸氢钠反应生成二氧化碳,符合除杂原则,中和反应是酸碱反应生成盐和水的反应;
C、除杂原则不能引入新的杂质,复分解反应是两种化合物相互交换离子的反应;
D、碳酸钠和盐酸反应,通过蒸发得到氯化钠,反应类型符合复分解反应.
A、氧化铜和一氧化碳反应生成铜和二氧化碳,除去了一氧化碳同时引入了二氧化碳,同时加热时有可能引起爆炸,化合反应是多变一的反应;
B、氯化氢和碳酸氢钠反应生成二氧化碳,符合除杂原则,中和反应是酸碱反应生成盐和水的反应;
C、除杂原则不能引入新的杂质,复分解反应是两种化合物相互交换离子的反应;
D、碳酸钠和盐酸反应,通过蒸发得到氯化钠,反应类型符合复分解反应.
解答:
解:A、CO和氧气混合气体加热可能爆炸,CO和氧化铜反应不属于化合反应,且除去CO同时引进新的杂质CO2,故A错误;
B、盐酸和碳酸氢钠的反应属于复分解反应,不属于中和反应,故B错误;
C、加入氯化钡,引进了新的杂质氯化钡,故C错误;
D、盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,属于复分解反应,故D正确;
故选D.
B、盐酸和碳酸氢钠的反应属于复分解反应,不属于中和反应,故B错误;
C、加入氯化钡,引进了新的杂质氯化钡,故C错误;
D、盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,属于复分解反应,故D正确;
故选D.
点评:本题考查了物质的分离、提纯和除杂及反应类型,较基础,注意根据除杂原则选择除杂试剂.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
在无色溶液中,下列离子能大量共存的是( )
| A、Na+、NH4+、NO3-、MnO4- |
| B、K +、SO42-、OH-、CO32- |
| C、K +、Fe3+、Cl-、Br- |
| D、Ba2+、Na+、OH-、CO32- |
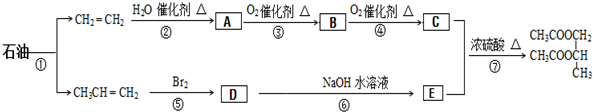
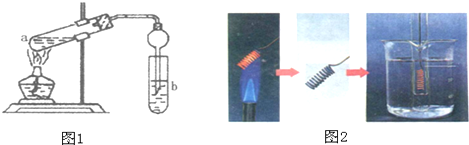
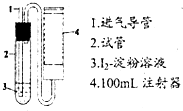 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
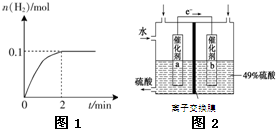 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应: