题目内容
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )| A. | 28g乙烯中的电子总数为12NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 5.85g氯化钠晶体中含有Na+数为0.1NA | |
| D. | 氢气和氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
分析 A、求出乙烯的物质的量,然后根据1mol乙烯中含16mol电子来分析;
B、求出氯化铵的物质的量,然后根据1mol氯化铵中含1mol氮原子来分析;
C、求出氯化钠的物质的量,然后根据1mol氯化钠中含1mol钠离子来分析;
D、H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,反应断裂1molH-H键和1molCl-Cl键时,生成2molHCl.
解答 解:A、28g乙烯的物质的量为1mol,而1mol乙烯中含16mol电子,即含16NA个,故A错误;
B、溶液中氯化铵的物质的量n=CV=0.1mol/L×1L=0.1mol,虽然铵根离子在溶液中会水解,但根据物料守恒可知,溶液中的氮原子仍为0.1NA个,故B错误;
C、5.85g氯化钠的物质的量为0.1mol,而1mol氯化钠中含1mol钠离子,故0.1mol氯化钠中含0.1NA个钠离子,故C正确;
D、H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,反应断裂1molH-H键和1molCl-Cl键时,生成2molHCl,故当生成标况下22.4L氯化氢即1molHCl时,断裂1mol化学键,即NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bm-、Cn-具有相同的电子层结构,且n>m,则下列关系正确的是( )
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |
17.下列数量的各物质所含原子总数按由大到小顺序排列的是( )
①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸(H3PO4)
①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸(H3PO4)
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①②④③ |
14.下列各组比较,不正确的是( )
| A. | 酸性:HI>HBr>HCl>HF | B. | 碱性:Be(OH)2<Mg(OH)2<KOH | ||
| C. | 氧化性:S<O2<F2 | D. | 还原性:O2-<S2-<I- |
1.下列各组物质中,在高温引燃的条件下,不能发生化学反应的是( )
| A. | Al粉和Fe3O4粉末混合 | B. | V2O5粉末和Al粉混合 | ||
| C. | Al粉和MgO粉末混合 | D. | C粉和CuO粉末混合 |
5.可逆反应N2(g)+3H2(g)?2NH3(g)500℃时在容积为5L的密闭容器中进行,开始时加入1molN2和1molH2,则达到平衡时,NH3的浓度不可能达到的值是( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.15mol/L | D. | 0.05mol/L |


 (或
(或 ).
). ,⑤的电子式是
,⑤的电子式是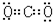 .
.