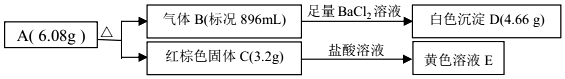
题目内容
5.化学与生产、生活、社会密切相关.下列说法中,正确的是( )| A. | 食用醋就是冰醋酸 | B. | 医用酒精浓度为75% | ||
| C. | 钢铁生锈主要是发生了析氢腐蚀 | D. | 汽车尾气的排放会引起臭氧空洞 |
分析 A.食用醋为冰醋酸的水溶液;
B.75%的乙醇消毒效果最好;
C.铁制品的锈蚀主要是由吸氧腐蚀引起的;
D.导致臭氧空洞主要是氟利昂.
解答 解:A.食用醋为冰醋酸的水溶液,属于混合物,食用醋为纯净物,故A错误;
B.75%的乙醇消毒效果最好,为医用酒精,故B正确;
C.由于空气形成的水膜大多数显中性或弱酸性,故铁制品的锈蚀主要是由吸氧腐蚀引起的,故C错误;
D.导致臭氧空洞主要是氟利昂,与减少汽车尾气的排放无关,故D错误;
故选:B.
点评 本题为综合题,考查了金属的腐蚀、环境保护、物质的组成,明确相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.下列说法中不正确的是( )
| A. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| B. | 新型无机非金属材料具有光学特性、生物功能、电学特性、耐高温、强度高 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如耐高温不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通信外,还可以用于医疗、信息处理等许多方面 |
20.某单质能跟足量浓HNO3反应,若参与反应的单质与硝酸的物质的量之比为1:4,则该单质在反应中所显示的化合价可能是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +5 |
10.下列说法中正确的是( )
| A. | 锂离子电池和普通锌锰干电池都是二次电池 | |
| B. | 原电池的反应的本质是氧化还原反应 | |
| C. | 燃料电池是一种高效但是会污染环境的新型电池 | |
| D. | 铅蓄电池放电的时候正极是Pb负极是PbO2 |
17.合金具有许多优良的物理、化学或机械性能.下列物质属于合金的是( )
| A. | 石墨 | B. | 陶瓷 | C. | 青铜 | D. | 水银 |
14.若不慎将汞温度计打碎在地面上,可在汞滴上覆盖一层物质以避免发生汞中毒,该物质是( )
| A. | 硫磺粉 | B. | 沙子 | C. | 石灰 | D. | 碱 |
15.下列关于有机化合物的说法正确的是( )
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 卤代烃和醇都可以发生消去 | |
| C. | 乙烯、聚氯乙烯和苯分子均含有碳碳双键 | |
| D. | 卤代烃、酯及酚均可发生水解反应 |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.