题目内容
15. (1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH
(1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH(2)已知离子反应:
①H2A+B-=HA-+HB
②H2A+2C-=A2-+2HC
则H2A、HA-、HB、HC的酸性由强到弱的排列顺序为H2A>HB>HA->HC
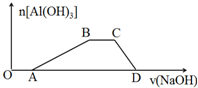
(3)向含有等物质的量浓度的HCl、NH4Cl、AlCl3混合溶液中滴加NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化关系如图.试写出①OA段和②CD段发生反应的离子方程式:①H++OH-=H2O②Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)乙烯含有碳碳双键,能够与水发生加成反应生成乙醇;葡萄糖发酵生成二氧化碳、乙醇;
(2)依据强酸制备弱酸规律解答;
(3)向含有等物质的量浓度的HCl、NH4Cl、AlCl3混合溶液中滴加NaOH溶液,氢氧化钠先与盐酸发生酸碱中和反应,然后与氯化铝发生复分解反应生成氢氧化铝和水,然后再与氯化铵发生复分解反应,最后与氢氧化铝发生复分解反应生成偏铝钠和水.
解答 解:(1)①乙烯含有碳碳双键,能够与水发生加成反应生成乙醇,方程式:CH2=CH2+H2O $→_{高温高压}^{催化剂}$ CH3CH2OH;
故答案为:CH2=CH2+H2O $→_{高温高压}^{催化剂}$ CH3CH2OH;
②葡萄糖发酵生成二氧化碳、乙醇,方程式:C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2 CH3CH2OH;
故答案为:C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2 CH3CH2OH;
(2)化学反应中强酸能制备酸性弱的酸;
依据方程式①H2A+B-=HA-+HB可知:H2A>HB>HA-;
依据②H2A+2C-=A2-+2HC可知:H2A>HA->HC;
所以酸性强弱顺序为:H2A>HB>HA->HC;
故答案为:H2A>HB>HA->HC;
(3)向含有等物质的量浓度的HCl、NH4Cl、AlCl3混合溶液中滴加NaOH溶液,氢氧化钠先与盐酸发生酸碱中和反应即OA段,反应的离子方程式:H++OH-=H2O,然后与氯化铝发生复分解反应生成氢氧化铝和水,然后再与氯化铵发生复分解反应,最后与氢氧化铝发生复分解反应生成偏铝钠和水即CD段,反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:①H++OH-=H2O ②Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了化学方程式的书写,溶液酸碱性强弱判断,明确有机物结构特点、熟悉强酸制备弱酸规律、把握图中各段发生反应是解题关键,题目难度中等.

| A. | 体积 | B. | 原子数 | C. | 质量 | D. | 密度 |
| A. | Na2CO3 NH4Cl CH3COOH H2SO4 | |
| B. | Na2CO3 H2SO4 CH3COOH NH4Cl | |
| C. | NH4Cl H2SO4 CH3COOH Na2CO3 | |
| D. | NH4Cl CH3COOH H2SO4 Na2CO3 |
| A. | CO2的结构式:O=C=O | B. | 乙醇分子的球棍模型: | ||
| C. | Cl-结构示意图: | D. | 四氯化碳的电子式: |
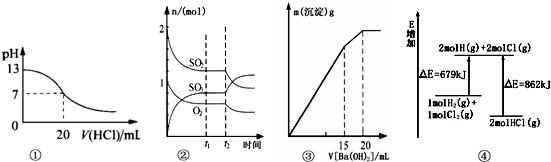
| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 | |
| B. | 图②表示一定条件下进行的反应2SO2(g)+O2(g)?2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 | |
| C. | 图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 图④表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
| A. | pH=1的溶液:Na+、C2O42-、MnO4-、SO42- | |
| B. | pH=12的溶液中:CO32-、Na+、AlO2-、S2-、SO32- | |
| C. | 水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-、CO32-、NO3-、SO32- | |
| D. | 中性溶液中:Fe3+、Al3+、NO3-、Cl-、 |
| A. | 盐汽水 | B. | 矿泉水 | C. | 自来水 | D. | 蒸馏水 |