��Ŀ����
16�����û�ѧ��Ӧԭ����������������⣺��1��������ˮ��Һ�д��ڵ���ƽ�⣬����0.1mol•L-1����ĵ���ƽ�ⳣ�����±���
| ���� | ����ƽ�ⳣ����25�棩 |
| HClO | K=2.98��10-8 |
| H2CO3 | K1=4.3��10-7 K2=5.6��10-11 |
| H2SO3 | K1=1.54��10-2 K2=1.02��10-7 |
���������ӷ���ʽ���й�˵���������ac��
a��������CO2ͨ�����������Һ�У�2ClO-+H2O+CO2�T2HClO+CO32-
b��������SO2ͨ��̼������Һ�У�SO2+H2O+2CO32-�T2HCO3-+SO32-
c����ͬ�¶�ʱ�������ʵ���Ũ�ȵ���������������NaOH��Һ��ȫ�к�����NaOH�����ΪV��H2CO3����V��H2SO3����V��HClO��
d����ͬ�¶�ʱ����pH��������Һ�����ʵ���Ũ�ȹ�ϵ��c��Na2CO3����c��NaClO����c��Na2SO3��
�������ᣨH2SeO3��Ҳ��һ�ֶ�Ԫ���ᣬ�н�ǿ�������ԣ�����������Һ�в���ͨ��SO2��������ɫ���ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ��H2SeO3+2SO2+H2O=Se��+2H2SO4��
��2����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����Ƕ����༰��̬ϵͳ������ܴ���������д������ŷţ�
���ڷ�ˮ�д���ƽ�⣺2CrO42-����ɫ��+2H+?Cr2O72-����ɫ��+H2O�����ı�����ʹ����ƽ�����淴Ӧ�����ƶ���������˵����ȷ����ad��
a��ƽ�ⳣ��Kֵ���Բ��ı�
b���ﵽ��ƽ��CrO42-���������ʵ���Cr2O72-����������
c���ﵽ��ƽ�����ҺpHһ������
d���ٴ�ƽ��ǰ�淴Ӧ����һ����������Ӧ����
��Cr2O72-��CrO42-�������ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��?Cr3+��aq��+3OH-��aq����������Cr��OH��3��Ksp=10-32����c��Cr3+������10-3 mol•L-1����Һ��pH����4ʱ��û�У���С���û�С�������������
��3����֪����2CH3OH��g��?CH3OCH3��g��+H2O��g��
��CO��g��+2H2��g��?CH3OH��g��
��CO��g��+H2O��g�� CO2��g��+H2��g��
ij�¶���������Ӧ��ƽ�ⳣ����ֵ����ΪK1��K2��K3������¶��·�Ӧ3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g���Ļ�ѧƽ�ⳣ��K=K1K22K3���ú�K1��K2��K3�Ĵ���ʽ��ʾ������ij�̶�������ܱ������м���3mol CO��3mol H2����ַ�Ӧ��ָ���ԭ�¶ȣ��ⶨ������ѹǿΪ��Ӧǰ��$\frac{1}{2}$����CO��ת����Ϊ75%��
���� ��1���ٸ��ݵ���Ϊ���ȹ����жϣ�
���ɱ������ݿ�֪����H2SO3��H2CO3��HSO3-��HClO��HCO3-����HClO���������ԣ�H2SO3���л�ԭ�ԣ�������Ե�ǿ���Լ������ˮ����
������������Һ�в���ͨ��SO2��������ɫ���ʣ�Ӧ����Se��˵�������������������������ԭ��Ӧ���������Se��
��2����ʹƽ��������Ӧ�����ƶ���������Ӧ��Ũ�Ȼ��С������Ũ�ȣ����¶Ȳ��䣬��ƽ�ⳣ�����䣻
�ڵ�c��Cr3+������10-3 mol•L-1����Һ��pH����4ʱ��c��OH-��=10-10mol/L�����Ksp���㲢�жϣ�
��3��ƽ�ⳣ��������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ�������ʽ���ʱ����ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮�����������ʽ����ʽ���㣮
��� �⣺��1��������ĵ���Ϊ���ȹ��̣����ȴٽ����룬ƽ�ⳣ���������¶ȣ�ƽ�ⳣ����С���ʴ�Ϊ����С��
���ɱ������ݿ�֪����H2SO3��H2CO3��HSO3-��HClO��HCO3-��
a��������CO2ͨ�����������Һ��Ӧ����HCO3-����Ӧ�����ӷ���ʽΪClO-+H2O+CO2=HClO+HCO3-����a����
b��������SO2ͨ��̼������Һ������HCO3-��SO32-�����ӷ���ʽΪSO2+H2O+2CO32-=2HCO3-+SO32-����b��ȷ��
c����ͬ�¶�ʱ�������ʵ�����������������NaOH��Һ��ȫ�кͣ���̼�ᡢ�����ᶼΪ��Ԫ�ᣬ������NaOH�����Ϊ��V��H2CO3��=V��H2SO3����V��HClO������c����
d���ζ�Ӧ���������Խ������ˮ��̶�Խ����ͬ�¶�ʱ����pHʱ����ҺŨ��ԽС������������Һ�����ʵ���Ũ�ȹ�ϵ��c��Na2CO3����c��NaClO����c��Na2SO3������d��ȷ��
�ʴ�Ϊ��ac��
������������Һ�в���ͨ��SO2��������ɫ���ʣ�Ӧ����Se��˵�������������������������ԭ��Ӧ���������Se������ʽΪH2SeO3+2SO2+H2O=Se��+2H2SO4���ʴ�Ϊ��H2SeO3+2SO2+H2O=Se��+2H2SO4��
��2����a�����¶Ȳ��䣬��ƽ�ⳣ��Kֵ���Բ��ı䣬��a��ȷ��
b�������ʹ�ϵ�Լ���������֪�ﵽ��ƽ��CrO42-���������ʵ���Cr2O72-���������ʵ�2������b����
c����������Һ������Ũ�ȣ���ƽ�������ƶ���ƽ���ƶ���ﵽ��ƽ����ҺpHһ����С����c����
d��ƽ��ʱ���淴Ӧ������ȣ�ƽ�������ƶ������ٴ�ƽ��ǰ����Ӧ����һ�������淴Ӧ���ʣ���d��ȷ��
�ʴ�Ϊ��ad��
�ڵ�c��Cr3+������10-3 mol•L-1����Һ��pH����4ʱ��c��OH-��=10-10mol/L��c��Cr3+��•c3��OH-��=10-33��10-32��û�г������ɣ�
�ʴ�Ϊ��û�У�
��3���ɸ�˹���ɿ�֪����Ӧ�١�2+��Ӧ��+��Ӧ����ӵ��ܷ��̣����ܷ��̵�ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮������K=K12•K2•K3��
3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g��
��ʼ��mol�� 3 3 x x
ת����mol�� x x $\frac{1}{3}$x $\frac{1}{3}$x
ƽ�⣨mol�� 3-x 3-x $\frac{2}{3}$x $\frac{2}{3}$x
������ѹǿΪ��Ӧǰ��$\frac{1}{2}$����$\frac{6-\frac{2}{3}x}{6}$=$\frac{1}{2}$��
x=2.25��
��CO��ת����Ϊ$\frac{2.25}{3}$��100%=75%��
�ʴ�Ϊ��K1K22K3��75%��
���� ���⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ�������ѧ���ķ��������������Ŀ��飬��Ŀ�漰��˹����Ӧ�á�������ʵĵ��롢ƽ�ⳣ���ļ���Ӧ�õ�֪ʶ��ע�⣨3������ʽ���ʱ����ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮������1���DZ�����״����Ƶ���㣬��Ŀ�Ѷ��еȣ�

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�| A�� | Na2CO3 NH4Cl CH3COOH H2SO4 | |
| B�� | Na2CO3 H2SO4 CH3COOH NH4Cl | |
| C�� | NH4Cl H2SO4 CH3COOH Na2CO3 | |
| D�� | NH4Cl CH3COOH H2SO4 Na2CO3 |
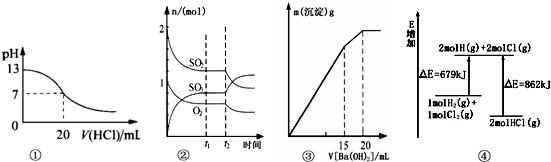
| A�� | ͼ�ٱ�ʾ25��ʱ����0.1 mol/L����ζ�20 mL 0.1 mol/L NaOH��Һ����Һ��pH�����������ı仯�õ��ĵζ����� | |
| B�� | ͼ�ڱ�ʾһ�������½��еķ�Ӧ2SO2��g��+O2��g��?2SO3��g����H��0���ɷֵ����ʵ����仯��t2ʱ�̸ı�����������ǽ����¶Ȼ���С������� | |
| C�� | ͼ�۱�ʾij������Һ�м���Ba��OH��2��Һ�����������������Ba��OH��2��Һ����Ĺ�ϵ���ڼ���20 mL Ba��OH��2��Һʱ������ǡ�ó�����ȫ | |
| D�� | ͼ�ܱ�ʾ��ѧ��ӦH2��g��+C12��g���T2HCl��g���������仯����÷�Ӧ�ķ�Ӧ�ȡ�H=��183 kJ/mol |
| A�� | pH=1����Һ��Na+��C2O42-��MnO4-��SO42- | |
| B�� | pH=12����Һ�У�CO32-��Na+��AlO2-��S2-��SO32- | |
| C�� | ˮ�����H+Ũ��c��H+��=10-12mol•L-1����Һ�У�Cl-��CO32-��NO3-��SO32- | |
| D�� | ������Һ�У�Fe3+��Al3+��NO3-��Cl-�� |
| ��� | ��Ӧ�� | ���� |
| �� | KMnO4��H2O2��H2SO4 | K2SO4��MnSO4�� |
| �� | Cl2��FeBr2 | FeCl3��FeBr3 |
| �� | KClO3��Ũ���� | Cl2���� |
| A�� | �ڢ��鷴Ӧ���������ΪH2O��O2 | |
| B�� | �ڢ��鷴Ӧ��Cl2��FeBr2�����ʵ���֮��Ϊ1��2 | |
| C�� | �ڢ��鷴Ӧ�л�ԭ������KCl������3 mol Cl2ת�Ƶ���6mol | |
| D�� | ��������ǿ����˳��ΪClO3-��Cl2��Br2��Fe3+ |
| A�� | �õ�ˮ���Լ�����������Һ�͵�����Һ | |
| B�� | ���ۡ���֬�͵�������һ�������¶��ܷ���ˮ�ⷴӦ | |
| C�� | ��ҵ��������֬�ڼ�Ĵ�������ˮ���������� | |
| D�� | ������Һ�м���Ũ��CuSO4��Һ����ʹ�����������������ᴿ |
| A�� | ���³�ѹ�£�2.24LNH3�к��й��ۼ�0.3mol | |
| B�� | �÷�Ӧ�����У�ÿ����1mol NaNH2��ת�Ƶ���2mol | |
| C�� | �ڸ÷�Ӧ�����£�Na�Ļ�ԭ��ǿ��H2 | |
| D�� | �÷�Ӧ�������ؼ������Ը������������Է����� |
| A�� | ����ˮ | B�� | ��Ȫˮ | C�� | ����ˮ | D�� | ����ˮ |
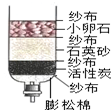
| A�� | �þ�ˮ���еĻ���̿���������� | B�� | �þ�ˮ�����Խ�������ˮ��Ӳ�� | ||
| C�� | �þ�ˮ������ɱ������������ | D�� | �þ�ˮ���ɽ�����ˮ��Ϊ����ˮ |