题目内容
3.利用H2和O2制备H2O2的原理为①H2(g)+A(1)?B(1)△H1 ②O2(g)+B(1)?A(1)+H2O2(1)△H2巳知:A、B均为有机物,两个反应均能自发进行,下列说法正确的是( )| A. | △H2>0 | |
| B. | B为H2和O2制备H2O2的催化剂 | |
| C. | 反应①的正反应的活化能大于逆反应的活化能 | |
| D. | H2(g)+O2(g)?H2O2(1)的△H<0 |
分析 A.②中△S<0,由△H-T△S<0 的反应可自发进行判断;
B.B为中间产物;
C.①中△S<0,由△H-T△S<0 的反应可自发进行,则△H1<0;
D.结合盖斯定律可知,①+②得到H2(g)+O2(g)?H2O2(1).
解答 解:A.②中△S<0,由△H-T△S<0 的反应可自发进行,由信息中两个反应均能自发进行,可知△H2<0,故A错误;
B.B为中间产物,A为为H2和O2制备H2O2的催化剂,故B错误;
C.①中△S<0,由△H-T△S<0 的反应可自发进行,则△H1<0,则反应①的正反应的活化能小于逆反应的活化能,故C错误;
D.结合盖斯定律可知,①+②得到H2(g)+O2(g)?H2O2(1),其△H=△H1+△H2<0,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握焓变的判断、综合判据的使用、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意焓变与活化能的关系,选项B为解答的易错点,题目难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
14.已知:W是组成信息高速公路骨架的元素之一,且X、Y、Z、W在元素周期表中的位置如图所示.下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 最高正化合价:X=W>Y>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
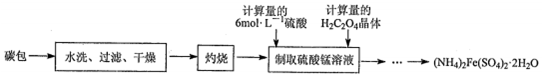
11.下列示意图与对应的化学反应关系不一致的是( )
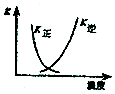 A.2SO2(g)+O2(g)?2SO3(g)△H<0 |  B.25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液 |
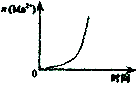 C.酸性KmnO4溶于与过量的H2C2O4溶液混合 |  D.CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,使用催化剂(a)和未使用催化剂(b) |
| A. | A | B. | B | C. | C | D. | D |
18.减少CO2的排放以及CO2的资源化利用具有重要意义.
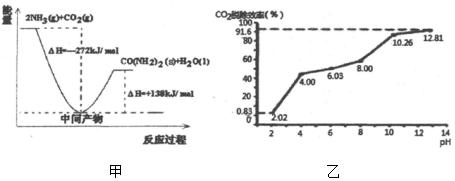
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol.
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式CO2+NH3.H2O=NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为0.13mol(精确到0.01).
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2.
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示.
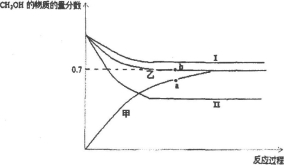
①能代表丙反应的曲线是I(选填I、II),a、b点的压强关系为Pa>Pb(填>、<、=),理由是平衡时a点甲醇的物质的量分数小,则总物质的量大.
②b点时反应吸收的能量为11.25kJ.

(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol.
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式CO2+NH3.H2O=NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为0.13mol(精确到0.01).
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2.
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示.

| 容器 | 甲 | 乙 | 丙 |
| 起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
②b点时反应吸收的能量为11.25kJ.
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y是地壳中含量最高的元素,W的原子序数是Y的2倍,X、Y、Z、W最外层电子数之和为19.下列说法正确的是( )
| A. | X和Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)>r(W)>r(Y) | |
| C. | W的简单气态氢化物的热稳定性比Y强 | |
| D. | 元素Z、W的简单离子具有相同的电子层结构 |
3.联苯(结构如图所示 ),碳碳单键可以旋转)的二氯代物有( )
),碳碳单键可以旋转)的二氯代物有( )
 ),碳碳单键可以旋转)的二氯代物有( )
),碳碳单键可以旋转)的二氯代物有( )| A. | 9种 | B. | 12种 | C. | 20种 | D. | 24种 |
1.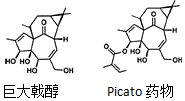 2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )
2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )
 2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )
2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )| A. | 由巨大戟醇制备Picato药物的另一种反应物是(CH3)2C=CHCOOH | |
| B. | 巨大戟醇能发生取代反应、氧化反应、加成反应 | |
| C. | 巨大戟醇和Picato药物都不属于芳香族化合物 | |
| D. | 0.1mol巨大戟醇完全燃烧消耗2.45molO2 |