题目内容
15. A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )| A. | 简单离子半径:D离子>C离子>A离子>B离子 | |
| B. | D元素氧化物的水化物一定是强酸 | |
| C. | B、C的简单离子都能破坏水的电离平衡 | |
| D. | 氢化物还原性:C>D |
分析 A、B、C、D为短周期主族元素,由25℃时其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系图可知,0.1mol/LHNO3的pH=1,0.1mol/LHClO4的pH=1,0.1mol/LNaOH溶液的pH=13,A为N元素,B为Na,D为Cl,C为第三周期元素,且C的最高价含氧酸为二元酸时pH<1,则C应为S,以此来解答.
解答 解:由上述分析可知,A为N,B为Na,C为S,D为Cl,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:C离子>D离子>A离子>B离子,故A错误;
B.D元素最高价氧化物的水化物一定是强酸,若不是最高价含氧酸可能为弱酸,故B错误;
C.钠离子不影响水的电离平衡,硫离子促进水的电离,故C错误;
D.非金属性Cl>S,则氢化物还原性:C>D,故D正确;
故选D.
点评 本题考查无机物的推断及原子结构与元素周期律,为高频考点,把握酸碱的pH来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
5.N2与O2的混合气体的密度对氢气的相对密度为14.5,则N2在混合气体中的质量分数为( )
| A. | 72.4% | B. | 75% | C. | 50% | D. | 80.5% |
3.下述实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 向硫酸铝溶液中滴加过量的氢氧化钡溶液 产生白色沉淀 | 证明氢氧化铝不溶于过量的氢氧化钡溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.四种短周期元素在周期表中的相对位置如表所示.X元素最常见气态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物.下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 简单离子半径:W>Z>Y | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | 最常见气态氢化物的沸点:Y>X>Z | |
| D. | 最高价氧化物对应的水化物酸性:Z>W |
20.元素X、Y、Z、W、Q、M在元素周期表的相对位置如表所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是( )
| X | Y | Z | |
| W | Q | M |
| A. | 对应氢化物的沸点Y>Q是因为Y的非金属性比Q强 | |
| B. | XM4的比例模型为  其二氢取代物有两种 其二氢取代物有两种 | |
| C. | W的氧化物,常温下可以和Z、M的氢化物反应 | |
| D. | Z的单质能将Y的单质从其氢化物中置换出来 |
7.下列过程放出热量的是( )
| A. | 冰的融化 | B. | 水的分解 | C. | 硝酸铵溶于水 | D. | 浓硫酸稀释 |
4.在卤代烃R-CH2-CH2-X中化学键如图所示,则下列说法正确的是( )
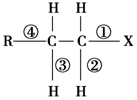

| A. | 发生水解反应时,被破坏的键是④ | |
| B. | 发生消去反应时,被破坏的键是①和② | |
| C. | 发生水解反应时,被破坏的键是①和④ | |
| D. | 发生消去反应时,被破坏的键是①和③ |
15.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液得到9克沉淀,对样品所含杂质的正确判断是( )
| A. | 肯定有KNO3,一定没有Na2CO3 | B. | 肯定没有Ba(NO3)2和KNO3 | ||
| C. | 肯定没有Ba(NO3)2,可能有Na2CO3 | D. | 肯定没有Ba(NO3)2,肯定有Na2CO3 |
 为探究乙烯与溴的加成反应,甲乙两名同学进行如图实验设计:
为探究乙烯与溴的加成反应,甲乙两名同学进行如图实验设计: