题目内容
10.四种短周期元素在周期表中的相对位置如表所示.X元素最常见气态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物.下列说法正确的是( )| X | Y | |
| Z | W |
| A. | 简单离子半径:W>Z>Y | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | 最常见气态氢化物的沸点:Y>X>Z | |
| D. | 最高价氧化物对应的水化物酸性:Z>W |
分析 X元素最常见气态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物,为铵盐,可知X为N元素,结合短周期元素在周期表的位置可知,Y为O,Z为S,W为Cl,然后结合元素周期律来解答.
解答 解:由上述分析可知,X为N,Y为O,Z为S,W为Cl,
A.电子层越多,离子半径越大,具有相同电子排布中原子序数大的离子半径小,则简单离子半径:Z>W>Y,故A错误;
B.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:Y>W>Z,故B错误;
C.水分子间含氢键,硫化物与HCl中相对分子质量大的沸点大,则最常见气态氢化物的沸点:Y>X>Z,故C正确;
D.非金属性越强,对应最高价氧化物的水化物酸性越强,则最高价氧化物对应的水化物酸性:Z<W,故D错误;
故选C.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.中学化学中所学很多“规律”都有其特定的使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据周期元素的原子半径变化趋势,推出Al的半径比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据同主族元素化学性质相似规律,推出Li在空气中完全燃烧的产物是Li2O2 | |
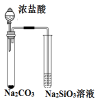
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入Na2SiO3溶液中能生成H2SiO3 |
18.环丙烷叉环丙烷结构为: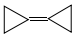 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 不可能是环丙烷的同系物 | ||
| C. | 与环己二烯(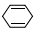 )是同分异构体 )是同分异构体 | D. | 所有的原子均在同一平面内 |
5.X、Y、Z、W四种短周期元素,化合物XZ可刻蚀玻璃,Y元素原子的最外层电子数是内层电子数的3倍,W+与Z的简单离子有相同的电子层排布.下列说法正确的是( )
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | W与另外三种元素均可形成离子键 | |
| C. | 简单离子半径:W>Y>Z | |
| D. | W和Y可形成阴阳离子个数比是1:1的化合物 |
15. A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
 A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )| A. | 简单离子半径:D离子>C离子>A离子>B离子 | |
| B. | D元素氧化物的水化物一定是强酸 | |
| C. | B、C的简单离子都能破坏水的电离平衡 | |
| D. | 氢化物还原性:C>D |
10.实验室中需要配制0.1mol/L的CuSO4溶液960ml,以下操作正确的是( )
| A. | 称取15.36 g CuSO4,加入1000 mL水 | |
| B. | 称取24.0 g CuSO4•5H2O,配成1000 mL溶液 | |
| C. | 称取16.0 g CuSO4,加入1000 mL水 | |
| D. | 称取25 g CuSO4•5H2O,配成1000 mL溶液 |
 ;
;