题目内容
14.下列各组中的性质比较,不正确的是( )| A. | 沸点:F2<Cl2<Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 离子半径:Na+>F->O2- |
分析 A.分子晶体中相对分子质量越大,沸点越高;
B.非金属性越强,对应最高价含氧酸的酸性越强;
C.金属性越强,对应碱的碱性越强;
D.具有相同电子排布的离子中,原子序数大的离子半径小.
解答 解:A.分子晶体中相对分子质量越大,沸点越高,则沸点:F2<Cl2<Br2,故A正确;
B.非金属性Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故B正确;
C.金属性K>Na>Mg,则碱性:KOH>NaOH>Mg(OH)2,故C正确;
D.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:Na+<F-<O2-,故D错误;
故选D.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
19.几种短周期元素的原子半径及主要化合价如表:
已知X是短周期中最活泼的金属,且与R同周期.下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | 含元素R的某种盐可作净水剂 |
6.下列说法正确的是( )
| A. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2 | |
| B. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| C. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 | |
| D. | NH3和NO2在一定条件下可发生氧化还原反应 |
3.下列关于元素周期律和元素周期表的论述中正确的是( )
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素最高价氧化物水化物酸性越强,则对应元素非金属性越强 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
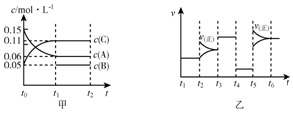 向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.
向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.