题目内容
3.下列关于元素周期律和元素周期表的论述中正确的是( )| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素最高价氧化物水化物酸性越强,则对应元素非金属性越强 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
分析 A.同一主族的元素从上到下金属性逐渐增强;
B.元素的非金属性越强,对应的最高价氧化物水化物酸性越强;
C.同一周期从左到右,元素原子半径逐渐减小;
D.一般来说,非金属元素的最高正化合价和它的负化合价的绝对值之和等于8.
解答 解:A.同一主族的元素从上到下,原子半径逐渐增大,原子核对最外层电子的吸引力减弱,则金属性逐渐增强,故A错误;
B.元素的非金属性越强,对应的最高价氧化物水化物酸性越强,故B正确;
C.同一周期从左到右,元素原子半径逐渐减小,故C错误;
D.如为ⅣA族元素,则最高正化合价等于它的负化合价的绝对值,如S,最高正化合价为6,而它的负化合价的绝对值为2,故D错误.
故选B
点评 本题考查了位置结构性质的相互关系及应用,为高考常见题型,侧重于学生的分析能力的考查,熟悉元素周期表结构及原子结构是解本题关键,结合元素周期律来分析解答,注意把握元素的性质与元素周期表的关系,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
14.下列各组中的性质比较,不正确的是( )
| A. | 沸点:F2<Cl2<Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 离子半径:Na+>F->O2- |
11.下列物质或其主要成分属于有机物的是( )
①酒精②碳酸钠③石墨④甲烷⑤红糖⑥碳酸⑦一氧化碳⑧石灰石⑨食用油⑩醋酸.
①酒精②碳酸钠③石墨④甲烷⑤红糖⑥碳酸⑦一氧化碳⑧石灰石⑨食用油⑩醋酸.
| A. | ①②④⑤⑨ | B. | ①④⑤⑨⑩ | C. | ①③④⑤⑦⑧⑨⑩ | D. | ①④⑤⑥⑩ |
18.在C(s)+CO2(g)?2CO(g)反应中,可使反应速率增大的措施是( )
①升高温度
②增加碳的量
③恒容通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥恒容通入CO.
①升高温度
②增加碳的量
③恒容通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥恒容通入CO.
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
8.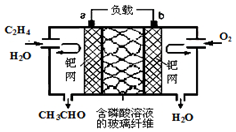 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
12.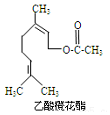 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
17. 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )
 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )| A. | 电流方向:电极Ⅰ→ →电极Ⅳ →电极Ⅳ | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电极Ⅱ质量不变 | D. | 电极Ⅲ的电极反应:2H++2e-═H2↑ |

 .
.