题目内容
6.已知:同温同压时,气体的体积之比等于它们的物质的量之比;同温恒容时,气体的压强之比等于它们的物质的量之比.请完成下列问题:(1)分别完全燃烧①甲烷、②乙烯、③苯,当它们的质量相等时,消耗氧气的量从大到小的次序为(填编号)①>②>③;当它们的物质的量相等时,消耗氧气的量从大到小的次序为(填编号)③>②>①.
(2)同温同压下,完全燃烧甲烷和苯蒸气的混合物所消耗氧气的量,与完全燃烧同体积的乙烯消耗氧气的量相等.甲烷和苯蒸气的混合物中,甲烷和苯蒸气的物质的量之比为7:2.
(3)某混合气体是由CO、H2、CH4中的两种或三种组成,若完全燃烧此种混合气,同温同压下消耗等体积的氧气.则原混合气中各气体的物质的量应满足的条件是一氧化碳和氢气的体积总和与甲烷体积之比为2:1,其中氢气和一氧化碳任意比.
(4)将某气态烃与氧气的混合气充入容积不变的密闭容器中,在高于100℃的条件下引燃,刚好完全燃烧.恢复至100℃时,测得燃烧前后容器内压强不变.该气态烃分子组成必须满足的条件是烃分子中氢原子数为4.
分析 (1)等质量烃完全燃烧,H元素的质量越大,耗氧量越大;等物质的量的烃CxHy完全燃烧时,(x+$\frac{y}{4}$)的值越大,耗氧量越大;
(2)同温同压下同体积气体物质的量相同,依据耗氧量相同列式计算甲烷和苯的物质的量之比;
(3)一氧化碳燃烧方程式2CO+O2=2CO2,氢气燃烧化学方程式为:2H2+O2=2H2O,甲烷燃烧生成二氧化碳和水的方程式为:CH4+2O2→CO2+2H2O,
其中一氧化碳和氢气燃烧耗氧量相同,且燃烧后生成气体体积和原来体积相同,所以一氧化碳和氢气任意比组合符合要求,依据若完全燃烧此种混合气,同温同压下消耗等体积的氧气,设CO和H2物质的量分别为x、y,计算混合气体和甲烷物质的量之比;
(4)气态烃完全燃烧100°C生成气体二氧化碳和水蒸气,依据烃燃烧通式和燃烧前后容器内压强不变列式计算,相同温度下气体压强之比等于气体物质的量之比.
解答 解:(1)等质量的烃CxHy完全燃烧时,氢元素的质量分数越大,耗氧量越大,CH4、C2H4、C6H6中的y:x值依次为4、2、1,故CH4中H元素质量分数最大,故等甲烷消耗O2最多,;等物质的量的烃CxHy完全燃烧,耗氧量取决(x+$\frac{y}{4}$),该值越大,耗氧量越多,①甲烷、②乙烯、③苯(C6H6)的(x+$\frac{y}{4}$)值分别为:2、3、7.5,故苯耗氧量最多,
故答案为:①>②>③;③>②>①;
(2)同温同压下,完全燃烧甲烷和苯蒸气的混合物所消耗氧气的量,与完全燃烧同体积的乙烯消耗氧气的量相等.设甲烷和苯蒸气的混合物中甲烷物质的量为x,苯物质的量为y,甲烷耗氧量2x,苯耗氧量7.5y,乙烯耗氧量3(x+y),依据耗氧量相同列式计算,2x+7.5y=(x+y)3
x:y=3.5
甲烷和苯蒸气的物质的量之比7:2,
故答案为:7:2;
(3)一氧化碳燃烧方程式2CO+O2=2CO2,氢气燃烧化学方程式为:2H2+O2=2H2O,甲烷燃烧生成二氧化碳和水的方程式为:CH4+2O2→CO2+2H2O,
其中一氧化碳和氢气燃烧耗氧量相同,且燃烧后生成气体体积和原来体积相同,所以一氧化碳和氢气任意比组合符合要求,依据若完全燃烧此种混合气,同温同压下消耗等体积的氧气,设CO和H2物质的量总和为x,甲烷物质的量为y,计算混合气体和甲烷物质的量之比;
x+y=0.5x+2y,x:y=2:1,则原混合气中各气体的物质的量应满足的条件是一氧化碳和氢气的体积总和与甲烷体积之比为2:1,氢气和一氧化碳任意比,
故答案为:一氧化碳和氢气的体积总和与甲烷体积之比为2:1,其中氢气和一氧化碳任意比;
(4)将某气态烃与氧气的混合气充入容积不变的密闭容器中,在高于100℃的条件下引燃,刚好完全燃烧.烃燃烧的通式为:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,恢复至100℃时,测得燃烧前后容器内压强不变,反应前后气体物质的量不变,1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,y=4,该气态烃分子组成必须满足的条件是分子式中氢原子数为4的烃,
故答案为:烃分子中氢原子数为4.
点评 本题考查阿伏伽德罗定律及其推论的分析计算、有机物耗氧量的计算、有机物分子式的确定,题目难度中等,注意从有机物燃烧的方程式结合体积的变化进行解答.

| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 质子数相同的微粒,它们的化学性质基本相同 | |
| C. | 苯和溴苯的混合物可用分液法分离 | |
| D. | 由“C(石墨)→C(金刚石)△H=+1.9 kJ/mol”可知石墨比金刚石稳定 |
| A. | 白磷晶体中,分子之间通过共价键结合 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-或(Na+) | |
| D. | 离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏 |
| A. | 32g O2所含的原子数目为NA | |
| B. | 0.5mol H2O含有的原子数目为1.5NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5mol |
| A. | 该原子核外有114个电子 | B. | 该原子的质子数是184 | ||
| C. | 第七周期有50种元素 | D. | 该元素的相对原子质量是298 |
| A. | 异戊烷 | B. | 新戊烷 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
①乙醇 ②醋酸溶液 ③水 ④盐酸.
| A. | ①>②>③>④ | B. | ④>②>③>① | C. | ①>③>②>④ | D. | ④>③>②>① |
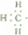 .
. .
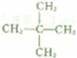
.
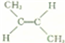
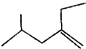 的系统命名4-甲基-2-乙基-1-戊烯.
的系统命名4-甲基-2-乙基-1-戊烯.