题目内容
14.下面有关晶体的叙述中,错误的是( )| A. | 白磷晶体中,分子之间通过共价键结合 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-或(Na+) | |
| D. | 离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏 |
分析 A.白磷为分子晶体;
B.根据金刚石的结构模型 判断;
判断;
C.氯化钠晶体中钠离子或氯离子的配位数都是6;
D.离子晶体的构成微粒是阴阳离子,分子晶体的构成微粒是分子.
解答 解:A.白磷为分子晶体,微粒之间存在分子间作用力,故A错误;
B.金刚石的结构为 ,由模型可知最小的环为六元环,故B正确;
,由模型可知最小的环为六元环,故B正确;
C.氯化钠晶体中钠离子或氯离子的配位数都是6,所以在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl-(或Na+),故C正确;
D.离子晶体的构成微粒是阴阳离子,分子晶体的构成微粒是分子,所以离子晶体在熔融状态下能电离出阴阳离子,而分子晶体在熔融状态下还是以分子存在,只破坏分子间作用力不破坏化学键,故D正确;
故选A.
点评 本题考查较为综合,涉及晶体的结构、共价键、氢键等知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
4.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | v正(CO)=v逆(H2O) | |
| B. | 2 mol H-O键断裂的同时有1 mol H-H键形成 | |
| C. | 生成n mol CO的同时生成n mol H2O(g) | |
| D. | 体系的压强不再发生变化 |
5.设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 1mol氯气跟足量的NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 1mol Na2O含离子数为3NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
2.下列装置或操作能达到实验目的是( )
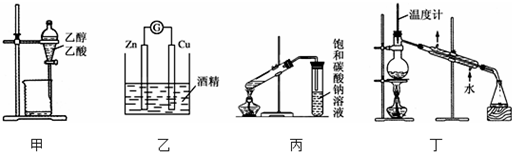

| A. | 甲装置可用来分离乙醇和乙酸 | |
| B. | 乙装置可以构成原电池 | |
| C. | 在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替 | |
| D. | 丁装置可以用来分离乙醇和丁醇和混合物 |
9.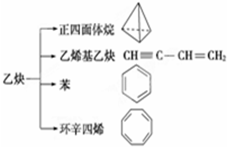 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )| A. | 正四面体烷的分子式为C4H4,其二氯代物有两种 | |
| B. | 苯为平面六边形结构,分子中存在C-C和C═C,能使酸性KMnO4溶液褪色 | |
| C. | 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同 | |
| D. | 环辛四烯跟苯的结构很像,不能使溴水褪色 |
19.下列说法中正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 阿伏加德罗常数就是6.02×1023 | |
| C. | 1mol某物质溶于水一定得阿伏加德罗常数个溶质分子 | |
| D. | 98gH2SO4的物质的量与98gH3PO4的物质的量相等 |
17.某烃分子中有一个由碳碳单键构成的六元环,有一个碳碳双键,还有一个碳碳叁键,则能满足上述条件的烃的分子式可能是( )
| A. | C8H8 | B. | C10H16 | C. | C14H22 | D. | C12H22 |