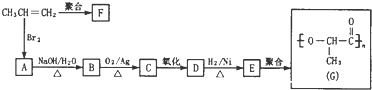
题目内容
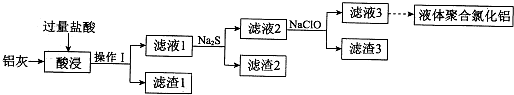
以铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m-n],生产的部分过程如图所示(部分产物和操作已略去).
已知某些硫化物的性质如下表:
(1)操作I是 .Al2O3与盐酸反应的离子方程式是 .
(2)滤渣2为黑色,该黑色物质的化学式是 .
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是 .
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是 .
(5)将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极).
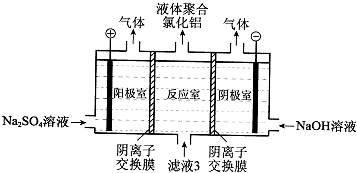
①写出阴极室的电极反应: .
②简述在反应室中生成聚合氯他铝的原理: .

已知某些硫化物的性质如下表:
| 物质 | 性质 |
| Fe2S3 Al2S3 | 在水溶液中不存在 |
| FeS | 黑色,难溶于水,可溶于盐酸 |
| CuS | 黑色,难溶于水,难溶于盐酸 |
(2)滤渣2为黑色,该黑色物质的化学式是
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是
(5)将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极).

①写出阴极室的电极反应:
②简述在反应室中生成聚合氯他铝的原理:
考点:制备实验方案的设计,电解原理
专题:实验设计题,电化学专题
分析:铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)加过量盐酸,过滤滤渣1为SiO2,滤液1中含有Al3+、Fe3+、Fe2+、Cu2+等,滤液中加硫化钠,Cu2+转化为CuS沉淀;过滤,滤液2中加NaClO把亚铁离子氧化为铁离子,铁离子易水解生成氢氧化铁沉淀,过滤,滤液3中为氯化铝;
(1)操作I是分离固体和液体混合物的操作;Al2O3与盐酸反应生成氯化铝和水;
(2)铜离子与硫离子结合生成CuS沉淀;
(3)亚铁离子被NaClO氧化为铁离子,铁离子易水解生成氢氧化铁沉淀;
(4)AlCl3水解生成Alm(OH)nCl3m-n和HCl,根据原子守恒配平方程式;
(5)①阴极上氢离子得电子生成氢气;
②阴离子交换膜只允许阴离子通过,则阴极室中的氢氧根离子进入反应室生成Alm(OH)nCl3m-n.
(1)操作I是分离固体和液体混合物的操作;Al2O3与盐酸反应生成氯化铝和水;
(2)铜离子与硫离子结合生成CuS沉淀;
(3)亚铁离子被NaClO氧化为铁离子,铁离子易水解生成氢氧化铁沉淀;
(4)AlCl3水解生成Alm(OH)nCl3m-n和HCl,根据原子守恒配平方程式;
(5)①阴极上氢离子得电子生成氢气;
②阴离子交换膜只允许阴离子通过,则阴极室中的氢氧根离子进入反应室生成Alm(OH)nCl3m-n.
解答:
解:铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)加过量盐酸,过滤滤渣1为SiO2,滤液1中含有Al3+、Fe3+、Fe2+、Cu2+等,滤液中加硫化钠,Cu2+转化为CuS沉淀;过滤,滤液2中加NaClO把亚铁离子氧化为铁离子,铁离子易水解生成氢氧化铁沉淀,过滤,滤液3中为氯化铝;
(1)操作I是分离固体和液体混合物的操作是过滤;Al2O3与盐酸反应生成氯化铝和水,其反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
故答案为:过滤;Al2O3+6H+=2Al3++3H2O;
(2)溶液中含有铜离子,加入硫化钠,生成CuS黑色沉淀;故答案为:CuS;
(3)向滤液2中含有亚铁离子,加入NaClO溶液,亚铁离子被NaClO氧化为铁离子,铁离子易水解生成氢氧化铁沉淀;故答案为:将Fe2+氧化为Fe3+,使Fe3+转化为Fe(OH)3沉淀;
(4)AlCl3水解生成Alm(OH)nCl3m-n和HCl,根据原子守恒配平方程式为:mAlCl3+nH2O=Alm(OH)nCl3m-n+nHCl;
故答案为:mAlCl3+nH2O=Alm(OH)nCl3m-n+nHCl;
(5)①阴极上氢离子得电子生成氢气,则阴极的电极反应式为:2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;
②阴离子交换膜只允许阴离子通过,电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子进入反应室生成Alm(OH)nCl3m-n;
故答案为:电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子通过阴离子交换膜进入反应室,生成聚合氯化铝.
(1)操作I是分离固体和液体混合物的操作是过滤;Al2O3与盐酸反应生成氯化铝和水,其反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
故答案为:过滤;Al2O3+6H+=2Al3++3H2O;
(2)溶液中含有铜离子,加入硫化钠,生成CuS黑色沉淀;故答案为:CuS;
(3)向滤液2中含有亚铁离子,加入NaClO溶液,亚铁离子被NaClO氧化为铁离子,铁离子易水解生成氢氧化铁沉淀;故答案为:将Fe2+氧化为Fe3+,使Fe3+转化为Fe(OH)3沉淀;
(4)AlCl3水解生成Alm(OH)nCl3m-n和HCl,根据原子守恒配平方程式为:mAlCl3+nH2O=Alm(OH)nCl3m-n+nHCl;
故答案为:mAlCl3+nH2O=Alm(OH)nCl3m-n+nHCl;
(5)①阴极上氢离子得电子生成氢气,则阴极的电极反应式为:2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;
②阴离子交换膜只允许阴离子通过,电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子进入反应室生成Alm(OH)nCl3m-n;
故答案为:电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子通过阴离子交换膜进入反应室,生成聚合氯化铝.
点评:本题是一道关于物质的分离和提纯知识的实验操作题,涉及基本实验操作、沉淀的生成、氧化还原反应、电解原理的应用等,侧重于考查学生分析和解决问题的能力,题目难度中等.

练习册系列答案
相关题目
在一种一元碱ROH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,下列判断中一定正确的是( )
| A、加入的一元酸HA过量 |
| B、生成的盐RA不能发生水解 |
| C、加入的酸与碱的物质的量相等 |
| D、反应后溶液中C(A-)=C(R+) |
X、Y、Z为三种短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子与Y原子的最外层电子数之差为3.下列叙述正确的是( )
| A、X、Y、Z三种元素不能组成一种盐 |
| B、X单质与Z单质直接反应可生成两种化合物 |
| C、X、Y、Z的最高价氧化物对应的水化物,可能是酸、碱或两性的物质 |
| D、X、Y形成的一种离子跟H+反应可生成Y的离子 |
短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( )
| A、X与Y不可能位于同一主族 |
| B、X与Y一定位于同一周期 |
| C、X与Y可能形成共价化合物XY |
| D、X与Y可能形成离子化合物XY |