题目内容
20.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag═Tl++2Ag+且已知Ag++Fe2+═Ag+Fe3+,则下列推断正确的是( )| A. | Tl+最外层有3个电子 | |
| B. | 氧化性:Tl3+>Ag+>Fe3+ | |
| C. | Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | |
| D. | 铊位于第五周期 IIIA族 |
分析 A、依据铊(Tl)与铝同主族,最外层电子数为3;
B、氧化还原反应中氧化剂的氧化性大于氧化产物,依据题干反应判断;
C、同主族从上到下,金属元素的最高价氧化物的水化物的碱性增强;
D、根据原子序数推断元素周期表中的位置.
解答 解:A、铊(Tl)与铝同主族,主族元素原子最外层电子相同,则Tl+最外层有2个电子,故A错误;
B、Tl3++2Ag=Tl++2Ag+,且Ag++Fe2+=Ag+Fe3+.氧化剂Tl3+的氧化性大于氧化产物Ag+,氧化剂Ag+的氧化性大于氧化产物Fe3+,所以氧化性顺序为Tl3+>Ag+>Fe3+,故B正确;
C、同主族从上到下,金属元素的最高价氧化物的水化物的碱性增强,则Tl(OH)3的碱性大于Al(OH)3,不是两性氢氧化物,故C错误;
D、原子序数为81,和铝同主族,结合核外电子排布规律写出原子结构示意图判断,铊位于第六周期第ⅢA族,故D错误;
故选B.
点评 本题考查了氧化还原反应的概念应用,规律分析和判断,元素周期表中位置的推断,熟练掌握氧化还原反应的实质和强弱规律,是解题的关键.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
19.设NA表示阿伏加德罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
11.甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
则x=413.
(2)若T℃时将6molCO2和 8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间的变化如图1中状态Ⅰ(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.
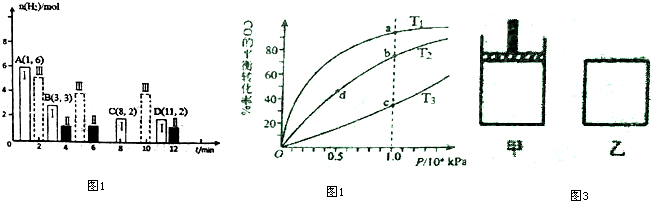
①T℃时状态I条件下,0--3min内CH3OH的平均反应速率v=0.28mol/(L•min)(保留两位有效数字),
平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强.
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是abc
a.容器中压强不变
b.CO2和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH )
d.气体的密度不再随时间的改变而变化
④CO与H2在密闭容器中发生反应①,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是A
A.温度:T1<T2<T3
B.正反应速率:v(a)>v(c);v(b)>v(d)
C.平衡常数:K(a)>K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
⑤800K向下列起始体积相同的密闭容器中充入1molCO、2molH2发生反应①,如图3所示甲容器在反应过程中保持压强不变,乙容器保持体积不变达到平衡时H2的浓度c (H2)甲>c(H2)乙.
①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)若T℃时将6molCO2和 8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间的变化如图1中状态Ⅰ(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.

①T℃时状态I条件下,0--3min内CH3OH的平均反应速率v=0.28mol/(L•min)(保留两位有效数字),
平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强.
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是abc
a.容器中压强不变
b.CO2和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH )
d.气体的密度不再随时间的改变而变化
④CO与H2在密闭容器中发生反应①,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是A
A.温度:T1<T2<T3
B.正反应速率:v(a)>v(c);v(b)>v(d)
C.平衡常数:K(a)>K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
⑤800K向下列起始体积相同的密闭容器中充入1molCO、2molH2发生反应①,如图3所示甲容器在反应过程中保持压强不变,乙容器保持体积不变达到平衡时H2的浓度c (H2)甲>c(H2)乙.
8.下列关于天然物质水解的叙述正确的是( )
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
15.下列判断错误的是( )
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
12.下列除去杂质的方法不正确的是( )
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | FeCl2溶液中混有少量的FeCl3:加入足量的铁粉后过滤 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
10.下列说法正确的是( )
| A. | pH=3的盐酸和pH=5的硫酸溶液等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,存在H+ | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol•L-1 | |
| D. | 在0.1mol•L-1 HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
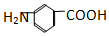 和
和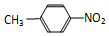 C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl
C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl