题目内容
9.拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.则1mol N2生成NH3 放出(填“吸收”或“放出”)92kJ;1mol H2生成NH3放出热量(填“吸收”或“放出”)$\frac{92}{3}$kJ;理论上,每生成1mol NH3,热量放出(填“吸收”或“放出”)46kJ;事实上,反应的热量总小于(填“大于”或“小于”)理论值.分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算反应热并判断吸热还是放热,可逆反应的特征:不能进行彻底.
解答 解:在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,则1mol N2生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,1molH2生成$\frac{2}{3}$molNH3,放出热量为$\frac{2}{3}$×46KJ=$\frac{92}{3}$kJ,生成1mol NH3,放出的热量为:$\frac{1}{2}$(2346kJ-2254kJ)=46kJ,由于该反应是可逆的,不能进行彻底,所以实际放出的能量比理论值要小,
故答案为:放出;92;放出;$\frac{92}{3}$;放出;46;小于.
点评 本题考查反应热的计算,为高频考点,侧重考查学生的分析、计算能力,题目难度不大,注意把握从键能的角度计算反应热的方法:焓变=反应物总键能-生成物的总键能.

练习册系列答案
相关题目
20.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag═Tl++2Ag+且已知Ag++Fe2+═Ag+Fe3+,则下列推断正确的是( )
| A. | Tl+最外层有3个电子 | |
| B. | 氧化性:Tl3+>Ag+>Fe3+ | |
| C. | Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | |
| D. | 铊位于第五周期 IIIA族 |
17.苏丹红是很多国家禁止用于食品生产的合成色素,其结构简式如下:

关于苏丹红的下列说法中错误的是( )

关于苏丹红的下列说法中错误的是( )
| A. | 属于芳香烃 | B. | 分子中含二个苯环 | ||
| C. | 能被酸性高锰酸钾溶液氧化 | D. | 能溶于苯 |
4.能用于鉴别Na2CO3固体和NaHCO3固体的方法是( )
| A. | 加稀盐酸 | B. | 加NaOH溶液 | C. | 焰色反应 | D. | 加热 |
14.下列反应的离子方程式书写中,正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 醋酸与氧化钠反应:Na2O+2H+═2Na++H2O |
1.下列说法啊正确的为( )
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③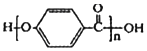 的结构中含有酯基
的结构中含有酯基
④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物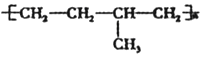 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得
⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③
 的结构中含有酯基
的结构中含有酯基④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物
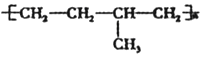 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
| A. | ①③⑤ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③④ |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| B. | 稀硫酸中:K+、Mg2+、AlO2-、S2O32- | |
| C. | 常温下:$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入硫氰化钾显红色的溶液:K+、NH4+、Cl-、I- |
19.分类是学习化学常用的方法,下列关于物质的分类说法正确的是( )
| A. | CO2、SO2、CO都是酸性氧化物 | B. | Na2O、Al2O3、CuO都是碱性氧化物 | ||
| C. | HCl、HClO、HClO4都是强酸 | D. | CH3COOH、HNO3、HSCN都是一元酸 |