题目内容
10.下列说法正确的是( )| A. | pH=3的盐酸和pH=5的硫酸溶液等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,存在H+ | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol•L-1 | |
| D. | 在0.1mol•L-1 HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
分析 A、酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;
B、任何水溶液中均存在氢离子;
C、中性溶液的pH不一定为7;
D、在酸溶液中加入蒸馏水,氢离子浓度降低,根据水的离子积来分析.
解答 解:A、pH=3的盐酸和pH=5的硫酸等体积混合后,设体积均为VL,混合液中氢离子的物质的量为:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,则混合溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-3}Vmol}{2VL}$=5×10-4mol/L,所以pH=-lg5×10-4=4-lg5=3.3,故A错误;
B、任何水溶液中均存在氢离子,故在pH=9的碱溶液中,也存在氢离子,故B正确;
C、中性溶液的c(H+)=c(OH-),但pH不一定为7,故c(H+)=c(OH-),但浓度不一定是1×10-7mol•L-1,故C错误;
D、在酸溶液中加入蒸馏水,氢离子浓度降低,根据水的离子积可知,溶液中的氢氧根的浓度升高,故D错误.
故选B.
点评 本题考查了混合液的pH的计算,题目难度不大,试题侧重基础知识的考查,注意掌握pH的表达式及计算方法,明确溶液酸碱性与溶液pH的关系为解答关键,试题有利于培养学生的化学计算能力.

练习册系列答案
相关题目
20.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag═Tl++2Ag+且已知Ag++Fe2+═Ag+Fe3+,则下列推断正确的是( )
| A. | Tl+最外层有3个电子 | |
| B. | 氧化性:Tl3+>Ag+>Fe3+ | |
| C. | Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | |
| D. | 铊位于第五周期 IIIA族 |
1.下列说法啊正确的为( )
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③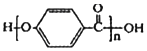 的结构中含有酯基
的结构中含有酯基
④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物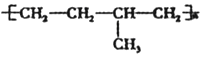 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得
⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③
 的结构中含有酯基
的结构中含有酯基④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物
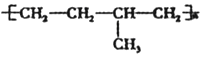 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
| A. | ①③⑤ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③④ |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| B. | 稀硫酸中:K+、Mg2+、AlO2-、S2O32- | |
| C. | 常温下:$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入硫氰化钾显红色的溶液:K+、NH4+、Cl-、I- |
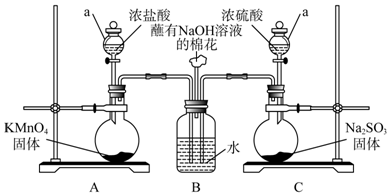
5.观察如图,下列叙述中错误的是( )


| A. | 图示实验中发生了化学变化 | |
| B. | 液体X的pH>7,液体Y是一种黑色黏稠状液体 | |
| C. | 气体Z易燃,可还原CuO | |
| D. | 液体Y是一种纯净物 |
19.分类是学习化学常用的方法,下列关于物质的分类说法正确的是( )
| A. | CO2、SO2、CO都是酸性氧化物 | B. | Na2O、Al2O3、CuO都是碱性氧化物 | ||
| C. | HCl、HClO、HClO4都是强酸 | D. | CH3COOH、HNO3、HSCN都是一元酸 |
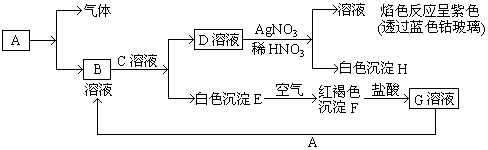

 .
.