题目内容
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )


| A、30 min~40 min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30~40min改变的条件是将容器的体积扩大至原来的2倍 |
| D、在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
考点:化学平衡建立的过程,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A.由图象可知,30min-40min之间,反应速率降低了,平衡不移动,反应物与生成物的浓度瞬时降低,催化剂不能改变浓度;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1.则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应;
C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,根据浓度变化计算体积扩大倍数;
D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动.
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1.则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应;
C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,根据浓度变化计算体积扩大倍数;
D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动.
解答:
解:A.由图象可知,30~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误;
C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,A的浓度由1mol/L变为0.75mol/L,故体积变为原来的
倍,故C错误;
D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,故K2=K1.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动,平衡常数减小,故则K3<K2=K1,故D正确;
故选D.
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误;
C、由图象可知,30min时正、逆反应速率降低,A、C的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,A的浓度由1mol/L变为0.75mol/L,故体积变为原来的
| 4 |
| 3 |
D.由C中分析可知,30~40 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,故K2=K1.由图可知,40min时改变的条件,瞬间A、C的浓度不变,正、逆速率都增大,应为升高温度,到达平衡时A的浓度降低,C的浓度增大,平衡向逆反应移动,平衡常数减小,故则K3<K2=K1,故D正确;
故选D.
点评:本题考查化学平衡图象问题,题目难度较大,注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响反应速率的条件,本题易错,答题时注意思考,D选项注意根据54min平衡时浓度变化判断.

练习册系列答案
相关题目
下列关于电解饱和食盐水制取氯气的说法正确的是( )
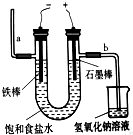

| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
| ||
| B、100 mL 0.1 mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01 NA | ||
| C、0.1 mol CH4所含质子数为NA | ||
| D、0.5mol C2H4中含有的C=C双键数为NA |
某气态的烷烃与烯烃的混合气体9g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2g,则原混合气体的组成为( )
| A、甲烷,乙烯 |
| B、乙烷,乙烯 |
| C、甲烷,丙烯 |
| D、甲烷,丁烯 |

 ①若Y是盐酸,则溶液中含有的金属阳离子是
①若Y是盐酸,则溶液中含有的金属阳离子是