题目内容
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20g A全部溶于0.15L6.0mol?L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.
请填空:
(1)①产物中的单质B是 .
(2)②中所发生的各反应的化学方程式是 , .
(3)③中所发生的各反应的离子方程式是 , .
(4)NaClO是一种很强的氧化剂,请写出酸性环境中NaClO将Fe2+氧化的离子方程式 .
(5)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 .
①取适量A进行铝热反应,产物中有单质B生成;
②另取20g A全部溶于0.15L6.0mol?L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.
请填空:
(1)①产物中的单质B是
(2)②中所发生的各反应的化学方程式是
(3)③中所发生的各反应的离子方程式是
(4)NaClO是一种很强的氧化剂,请写出酸性环境中NaClO将Fe2+氧化的离子方程式
(5)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为
考点:有关混合物反应的计算
专题:计算题
分析:(1)①铝热反应本质是置换反应,金属性Mg>Al>Fe,所以发生的反应为Al与Fe2O3反应,置换出的B是铁;
(2)②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
(3)③放出1.12L(标准状况)气体,说明生成氢气,Fe2O3与盐酸反应生成氯化铁与水,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
(4)次氯酸根离子具有氧化性,将亚铁离子氧化成铁离子,根据化合价升降相等配平反应的离子方程式;
(5)设MgO和Fe2O3的物质的量都为xmol,根据二者质量计算x的值,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知n(Mg2+)=n(MgO);亚铁离子来自反应Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+,根据题中数据计算出亚铁离子的物质的量,再根据c=
计算镁离子、亚铁离子浓度.
(2)②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
(3)③放出1.12L(标准状况)气体,说明生成氢气,Fe2O3与盐酸反应生成氯化铁与水,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
(4)次氯酸根离子具有氧化性,将亚铁离子氧化成铁离子,根据化合价升降相等配平反应的离子方程式;
(5)设MgO和Fe2O3的物质的量都为xmol,根据二者质量计算x的值,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知n(Mg2+)=n(MgO);亚铁离子来自反应Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+,根据题中数据计算出亚铁离子的物质的量,再根据c=
| n |
| V |
解答:
解:(1)①MgO和Fe2O3组成的混合物行铝热反应,发生Al与Fe2O3反应方程式为:Fe2O3+2Al
Al2O3+2Fe,所以B为铁,
故答案为:Fe;
(2)②MgO与盐酸反应生成氯化镁与水,反应的方程式为:MgO+2HCl=MgCl2+H2O;Fe2O3与盐酸反应生成氯化铁与水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O,
故答案为:MgO+2HCl=MgCl2+H2O;Fe2O3+6HCl=2FeCl3+3H2O;
(3)③放出1.12L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为Fe与盐酸反应生成氯化亚铁与氢气,反应离子方程式为:Fe+2H+=Fe2++H2↑;铁与氯化铁反应生成氯化亚铁,反应离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+;
(4)亚铁离子被次氯酸根离子氧化成铁离子,亚铁离子变成铁离子,化合价升高1价,次氯酸根离子变成氯离子,化合价降低2价,则亚铁离子的计量数为2,次氯酸根离子的计量数为1,然后根据质量守恒配平,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(5)设MgO和Fe2O3的物质的量都为xmol,则40x+160x=20,解得x=0.1,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO)=0.1mol,溶液D的体积仍视为0.15L,所以c(Mg2+)=
≈0.67mol/L;
0.1mol氧化铁溶于盐酸生成0.2mol氯化铁,根据反应Fe+2Fe3+=3Fe2+可知,生成亚铁离子的物质的量为:n(Fe2+)=0.2mol×
=0.3mol,
标况下l.12L(标况)气体的物质的量为:
=0.05mol,根据反应Fe+2H+=Fe2++H2↑可知,生成0.05mol氢气会生成0.05mol亚铁离子,则溶液D中含有亚铁离子的物质的量为:0.3mol+0.05mol=0.35mol,试题c(Fe2+)=
≈2.3mol/L,
故答案为:0.67mol/L;2.3mol/L.
| ||
故答案为:Fe;
(2)②MgO与盐酸反应生成氯化镁与水,反应的方程式为:MgO+2HCl=MgCl2+H2O;Fe2O3与盐酸反应生成氯化铁与水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O,
故答案为:MgO+2HCl=MgCl2+H2O;Fe2O3+6HCl=2FeCl3+3H2O;
(3)③放出1.12L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为Fe与盐酸反应生成氯化亚铁与氢气,反应离子方程式为:Fe+2H+=Fe2++H2↑;铁与氯化铁反应生成氯化亚铁,反应离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+;
(4)亚铁离子被次氯酸根离子氧化成铁离子,亚铁离子变成铁离子,化合价升高1价,次氯酸根离子变成氯离子,化合价降低2价,则亚铁离子的计量数为2,次氯酸根离子的计量数为1,然后根据质量守恒配平,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(5)设MgO和Fe2O3的物质的量都为xmol,则40x+160x=20,解得x=0.1,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO)=0.1mol,溶液D的体积仍视为0.15L,所以c(Mg2+)=
| 0.1mol |
| 0.15L |
0.1mol氧化铁溶于盐酸生成0.2mol氯化铁,根据反应Fe+2Fe3+=3Fe2+可知,生成亚铁离子的物质的量为:n(Fe2+)=0.2mol×
| 3 |
| 2 |
标况下l.12L(标况)气体的物质的量为:
| 1.12L |
| 22.4L/mol |
| 0.35mol |
| 0.15L |
故答案为:0.67mol/L;2.3mol/L.
点评:本题考查混合物反应的计算、物质的量浓度计算,题目难度中等,掌握氧化镁、氧化铁以及铁和三价铁离子的反应原理为解答的关键,(5)中计算亚铁离子的物质的量时,不可忽略了铁与氢离子的反应.

练习册系列答案
相关题目
下列解释事实的化学方程式或离子方程式,不正确的是( )
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
化学中的平衡:如化学平衡、溶解平衡、电离平衡.下列不存在平衡的是(不考虑水的电离平衡)( )
| A、稀醋酸溶液中 |
| B、氢氧化钙悬浊液中 |
| C、二氧化硫与氧气反应的混合物中 |
| D、稀氯化钠水溶液中 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )


| A、30 min~40 min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30~40min改变的条件是将容器的体积扩大至原来的2倍 |
| D、在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同.则该混合气体中CO2、H2和CO的体积比不可能为( )
| A、39:24:13 |
| B、22:7:14 |
| C、13:8:29 |
| D、26:16:57 |
下列关于有机物的正确说法是( )
| A、聚乙烯可发生加成反应 |
| B、丁烷的二氯代物有9种同分异构体 |
| C、淀粉、蛋白质完全水解的产物互为同分异构体 |
| D、纤维素和油脂都是高分子化合物 |
某学习小组设计如下实验方案,相关推测不合理的是( )
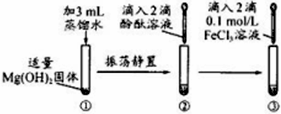

| A、试管②滴入酚酞后溶液可能变浅红 |
| B、试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C、试管③中的变化是物理变化 |
| D、上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
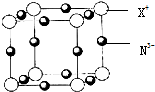 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.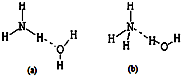 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.